class 11 chemistry chapter 5 notes in Hindi | class 11 chemistry notes in Hindi
class 11 chemistry chapter 5 notes
• Intermolecular Forces
अंत: आणविक बल, अंतःक्रियात्मक कणों के बीच आकर्षण और प्रतिकर्षण की शक्तियां हैं
स्थायी द्विध्रुवीय क्षण हैं। यह इंटरैक्शन लंदन बलों की तुलना में अधिक मजबूत है, लेकिन आयन-आयन इंटरैक्शन की तुलना में कमजोर है क्योंकि केवल आंशिक शुल्क शामिल हैं।
डिपोल के बीच की दूरी बढ़ने के साथ आकर्षक बल कम हो जाता है। अंतःक्रियात्मक ऊर्जा 1/r6के समानुपाती होती है जहाँ r ध्रुवीय अणुओं के बीच की दूरी होती है।
आयन-डिपोल इंटरेक्शन (Ion-Dipole Interaction): यह आकर्षण का वह बल है जो आयनों (cations या anions) और ध्रुवीय अणुओं के बीच मौजूद होता है। आयन द्विध्रुवीय अणुओं के विपरीत आवेशित अंत की ओर आकर्षित होता है।
Read also :- ncert solutions for class 11 chemistry chapter 6
आकर्षण की शक्ति आयन के चार्ज और आकार और द्विध्रुवीय क्षण और ध्रुवीय अणु के आकार पर निर्भर करती है।
उदाहरण के लिए: पानी में आम नमक (NaCl) की घुलनशीलता।
• Ion-induced Dipolar Interactions in chapter 5 chemistry class 11 notes
इस प्रकार की परस्पर क्रिया में ध्रुवीय अणु का स्थाई द्विध्रुव अपने इलेक्ट्रॉनिक बादल को विकृत करके विद्युत रूप से तटस्थ अणु पर द्विध्रुव को प्रेरित करता है। सहभागिता ऊर्जा 1/r6 के समानुपाती होती है जहाँ r दो अणुओं के बीच की दूरी है।
 |
| Ion-induced Dipolar Interactions |
• London Forces or Dispersion Forces in Hindi
जैसा कि हम जानते हैं कि गैर-ध्रुवीय अणुओं में, उनके इलेक्ट्रॉनिक होने के कारण कोई द्विध्रुवीय क्षण नहीं होता है।
चार्ज क्लाउड सममित रूप से वितरित किया गया है। लेकिन, यह माना जाता है कि किसी भी समय, अणु के इलेक्ट्रॉन बादल विकृत हो सकते हैं ताकि एक तात्कालिक द्विध्रुवीय या क्षणिक द्विध्रुवीय उत्पादन होता है
जिसमें अणु का एक हिस्सा दूसरे भाग की तुलना में थोड़ा अधिक नकारात्मक होता है।
यह क्षणिक द्विध्रुवीय पड़ोसी अणुओं में द्विध्रुव को प्रेरित करता है। इस प्रकार, आकर्षण का बल उनके बीच मौजूद है और स्थायी द्विध्रुवों के बीच के समान है।
आकर्षण के इस बल को लंदन की सेना या फैलाव बल के रूप में जाना जाता है।
ये बल हमेशा आकर्षक होते हैं और परस्पर ऊर्जा छठी शक्ति के विपरीत आनुपातिक होती है
दो अंतःक्रियात्मक कणों के बीच की दूरी, (अर्थात 1/r6 जहाँ r दो कणों के बीच की दूरी है)।
 |
| London Forces chapter 5 chemistry class 11 notes |
Hydrogen bonding in Hindi: जब हाइड्रोजन परमाणु सहसंयोजक बंधन द्वारा अत्यधिक इलेक्ट्रोनगेटिव तत्व से जुड़ा होता है, तो इलेक्ट्रॉनों को अधिक इलेक्ट्रोनगेटिव परमाणु की ओर स्थानांतरित कर दिया जाता है।
 |
| Hydrogen bonding |
इस प्रकार हाइड्रोजन परमाणु पर आंशिक धनात्मक आवेश विकसित होता है।
अब, एक अणु के धनात्मक आवेशित हाइड्रोजन परमाणु किसी अन्य अणु के ऋणात्मक आवेशित परमाणु को आकर्षित कर सकते हैं और दो अणुओं को आकर्षण बल की एक कमजोर शक्ति के माध्यम से एक साथ जोड़ा जा सकता है।
Thermal Energy: - शरीर की आणविक गति के कारण उत्पन्न होने वाली ऊर्जा को थर्मल ऊर्जा के रूप में जाना जाता है। चूंकि अणुओं की गति सीधे गतिज ऊर्जा से संबंधित होती है और गतिज ऊर्जा सीधे तापमान के आनुपातिक होती है।
• The Gaseous State in Hindi
गैसीय अवस्था के भौतिक गुण
(i) एसेस की कोई निश्चित मात्रा नहीं है और उनका कोई विशिष्ट आकार नहीं है,
(ii) गैसें बिना किसी यांत्रिक सहायता के सभी अनुपातों में समान रूप से और पूरी तरह से मिश्रित होती हैं।
(iii) उनका घनत्व ठोस और तरल पदार्थों की तुलना में बहुत कम है।
(iv) वे सभी दिशाओं में समान रूप से संकुचित और अत्यधिक दबाव वाले होते हैं।
• Boyle’s Law (Pressure-Volume Relationship) in class 11 chemistry chapter 5 notes
निरंतर तापमान पर, गैस के द्रव्यमान का आयतन इसके दबाव के व्युत्क्रमानुपाती होता है।
 |
| Boyle’s Law |
Charles’ law: निरंतर दबाव में, गैस के दिए गए द्रव्यमान का आयतन उसके निरपेक्ष तापमान के समानुपाती होता है।
 |
| Charles’ law |
• Gay Lussac’s Law (Pressure-Temperature Relationship)
निरंतर मात्रा में, गैस के दिए गए द्रव्यमान का दबाव सीधे तापमान के आनुपातिक होता है।
 |
| Gay Lussac’s Law |
• Avogadro Law (Volume-Amount Relationship)
अवोगाद्रो के नियम में कहा गया है कि तापमान और दबाव की समान परिस्थितियों में सभी गैसों की समान मात्रा में समान अणु होते हैं।
V α n
जहाँ n गैस के मोल्स की संख्या है।
एवोगैड्रो स्थिरांक: एक गैस के एक मोल में अणुओं की संख्या
= 6.022 x 1023
Read also :- Class 11 chemistry chapter 4 notes in Hindi
Ideal Gas: बॉयल के नियम, चार्ल्स के कानून और अवोगाद्रो कानून का सख्ती से पालन करने वाली गैस को आदर्श गैस कहा जाता है।
वास्तविक गैसें कुछ विशिष्ट परिस्थितियों में ही इन कानूनों का पालन करती हैं। जब बातचीत की ताकत व्यावहारिक रूप से नगण्य होती है।
• Ideal Gas Equation
यह तीन कानूनों का संयुक्त गैस समीकरण है और इसे आदर्श गैस समीकरण के रूप में जाना जाता है।
 |
| Ideal Gas Equation |
• Dalton’s Law of Partial Pressure in Hindi
जब दो या दो से अधिक गैर-प्रतिक्रियाशील गैसों को एक बर्तन में संलग्न किया जाता है, तो गैसीय मिश्रण द्वारा डाला गया कुल दबाव व्यक्तिगत गैसों के आंशिक दबाव के योग के बराबर होता है।
P1, P2 और P3 को तीन गैर प्रतिक्रियाशील गैसों A, B, और C. का दबाव बनाते हैं जब समान मात्रा में और एक ही स्थिति में अलग-अलग संलग्न किया जाता है।
PTotal = P1+ P2 + P3
जहाँ, PTotal = Pगैसों के मिश्रण द्वारा डाला जाने वाला कुल दबाव है।
• Aqueous Tension
गैर प्रतिक्रियाशील गैसों का दबाव आमतौर पर पानी पर एकत्र किया जाता है और इसलिए नम होता है। नम गैस के कुल दबाव से पानी के वाष्प दबाव को घटाकर सूखी गैस के दबाव की गणना की जा सकती है।
P2Dry gas = PTotal – Aqueous Tension
• Partial Pressure in terms of Mole Fraction
तापमान T पर, तीन गैसों को V में विभक्त किया जाता है, आंशिक दबाव P1, P2 और P3 को क्रमशः बढ़ाएँ, फिर
 |
| Partial Pressure in terms of Mole Fraction |
• Kinetic Molecular Theory of Gases
(i) गैसों में बड़ी संख्या में बहुत छोटे समान कण (परमाणु या अणु) होते हैं,
(ii) गैस अणु द्वारा अधिग्रहित वास्तविक मात्रा उनके बीच की खाली जगह की तुलना में नगण्य है।
(iii) गैसें उनके लिए उपलब्ध सभी स्थानों पर कब्जा कर सकती हैं। इसका मतलब है कि उनके कणों के बीच आकर्षण का कोई बल नहीं है।
(iv) गैस के कण हमेशा यादृच्छिक गति में होते हैं।
(v) जब गैस के कण यादृच्छिक गति में होते हैं, तो कंटेनर की दीवारों के साथ कणों की टक्कर के कारण गैस द्वारा दबाव डाला जाता है।
(vi) गैस के अणुओं का टकराव पूरी तरह से लोचदार होता है। इसका मतलब टक्कर के बाद ऊर्जा का कोई नुकसान नहीं है। टकराने वाले अणुओं के बीच ऊर्जा का केवल आदान-प्रदान हो सकता है।
(vii) एक विशेष तापमान पर गैसीय कणों के बीच गति का वितरण स्थिर रहता है।
(viii) गैसीय अणु की औसत गतिज ऊर्जा सीधे पूर्ण तापमान के आनुपातिक होती है।
• Deviation From Ideal Gas Behaviour
Real Gas: एक गैस जो तापमान और दबाव की सभी परिस्थितियों में आदर्श गैस व्यवहार का पालन नहीं करती है, उसे वास्तविक गैस कहा जाता है।
दबाव के संबंध में विचलन एक दिए गए तापमान पर दबाव बनाम वॉल्यूम वक्र की साजिश रचने से अध्ययन किया जा सकता है। (बॉयल के नियम)
 |
| Deviation From Ideal Gas Behaviour |
Compressibility factor (Z): आदर्श व्यवहार से विचलन को संपीड़ितता कारक, जेड के संदर्भ में मापा जा सकता है।
 |
| Compressibility factor (Z): |
• van der Waals Equation in class 11 chemistry chapter 5 notes
जहां V आणविक आकर्षण के लिए एक स्थिर है, जबकि is V आणविक मात्रा के लिए एक स्थिर है।
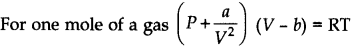 |
| van der Waals in hindi |
(b) गैस अणु द्वारा अधिग्रहित मात्रा गैस की कुल मात्रा की तुलना में नगण्य है।
गैस के गतिज सिद्धांत की दो मान्यताओं से ऊपर बहुत उच्च दबाव और कम तापमान पर गलत पाया गया था।
• Liquifaction of Gases
गैसों का तरलकरण या तो तापमान कम करने या एक साथ गैस के दबाव को बढ़ाकर प्राप्त किया जा सकता है।
 |
| Liquifaction of Gases |
Critical Temperature (Tc): इसे उस तापमान के रूप में परिभाषित किया जाता है जिसके ऊपर एक गैस को तरल नहीं किया जा सकता है, हालांकि गैस पर उच्च दबाव लागू किया जा सकता है।
Tc = 8a/27bR
(जहां ए और बी वैन डेर वाल्स कॉन्स्टेंट हैं)
Critical Pressure (Pc):यह महत्वपूर्ण तापमान पर गैस को लिक्विड करने के लिए आवश्यक दबाव है।
Pc = a/27b2
महत्वपूर्ण तापमान और महत्वपूर्ण दबाव में गैस के एक मोल द्वारा कब्जा की गई मात्रा को महत्वपूर्ण मात्रा (Vc) कहा जाता है।
उदाहरण के लिए। C02 के लिए परिसमापन।
Tc = 30.98°C
Pc = 73,9 atm.
Vc = 95-6 cm3/mole
तीनों को सामूहिक रूप से महत्वपूर्ण स्थिरांक कहा जाता है।
- Liquid State
Characteristics of Liquid State
(i) तरल में, गैस की तुलना में अंतर-आणविक बल मजबूत होते हैं।
(ii) उनके पास निश्चित मात्रा है लेकिन अनियमित आकार हैं या हम कह सकते हैं कि वे कंटेनर का आकार ले सकते हैं।
(iii) तरल पदार्थ के अणु आकर्षक अंतरमहाद्वीपीय शक्तियों द्वारा एक साथ रखे जाते हैं।
Vapour Pressure: किसी तरल के वाष्प के द्वारा गतिशील संतुलन की स्थिति में किसी विशेष तापमान पर दबाव डाला जाता है, उस तापमान पर उस तरल का वाष्प दाब कहलाता है।
वाष्प दाब दो कारकों पर निर्भर करता है:
(i) तरल की प्रकृति (ii) तापमान
 |
| Vapour Pressure |
• Surface Tension
इसे तरल की सतह पर खींची गई रेखा के लंबवत प्रति इकाई लंबाई के बल के रूप में परिभाषित किया जाता है।
S.I. unit of Surface Tension = Nm-1
तापमान में वृद्धि के साथ सतही तनाव कम हो जाता है, क्योंकि अणुओं की गतिज ऊर्जा में वृद्धि के कारण प्रति इकाई लंबाई अभिनय बल कम हो जाता है।
• Viscosity in ch 5 chemistry class 11
इसे किसी तरल पदार्थ के प्रवाह के आंतरिक प्रतिरोध के रूप में परिभाषित किया गया है।
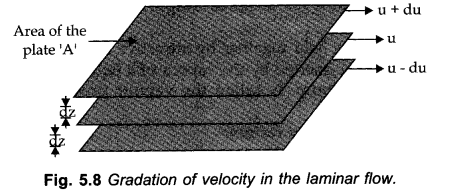 |
| ncert solutions for class 11 chemistry chapter 5 |
जब तरल बहता है, तो उसके नीचे की परत उसके प्रवाह को मंद करने की कोशिश करती है जबकि ऊपर वाला तेजी लाने की कोशिश करता है।
इस प्रकार, परतों के प्रवाह को बनाए रखने के लिए बल की आवश्यकता होती है।
 |
| ncert solutions class 11 chemistry chapter 5 |
Effect of Temp, on Viscosity: तरल पदार्थों का चिपचिपापन कम हो जाता है क्योंकि तापमान बढ़ जाता है क्योंकि उच्च तापमान पर, अणुओं में उच्च गतिज ऊर्जा होती है और एक दूसरे को पिछले करने के लिए इंटरमॉलिक्युलर बलों पर काबू पा सकते हैं।
• Boyle’s Law For class 11 chemistry chapter 5 notes : यह बताता है कि, गैस के द्रव्यमान के आइसोथर्मल स्थितियों के तहत इसकी मात्रा के विपरीत आनुपातिक है।
 |
| Boyle’s Law: |






.png)
.png)




No comments:
Post a Comment