ncert solutions for class 11 chemistry chapter 6
Important Terms and Definitions for class 11 chemistry chapter 6 :-
सिस्टम: ब्रह्मांड के उस हिस्से का संदर्भ देता है जो अवलोकन के अंतर्गत है।
परिवेश: ब्रह्मांड में प्रणाली को छोड़कर बाकी सभी चीजों को परिवेश कहा जाता है।
The Universe = The System + The Surroundings.
Open System: एक प्रणाली में, जब ऊर्जा और पदार्थ का आदान-प्रदान होता है
class 11 chemistry chapter 6 ncert solutions
परिवेश, तब इसे एक खुली प्रणाली कहा जाता है।
उदाहरण के लिए: एक खुले बीकर में अभिकारकों की उपस्थिति एक खुली प्रणाली का एक उदाहरण है। बंद प्रणाली: किसी प्रणाली को एक बंद प्रणाली कहा जाता है जब पदार्थ का कोई विनिमय नहीं होता है: लेकिन ऊर्जा का आदान-प्रदान संभव है।
उदाहरण के लिए: संचालन सामग्री से बने एक बंद बर्तन में अभिकारकों की उपस्थिति।
पृथक प्रणाली: एक प्रणाली में, जब ऊर्जा या पदार्थ का कोई भी आदान-प्रदान परिवेश के साथ नहीं होता है, पृथक प्रणाली कहलाती है।
उदाहरण के लिए: थर्मोक्लास्क में अभिकारकों की उपस्थिति, या एक अछूता बंद पोत में पदार्थ पृथक प्रणाली का एक उदाहरण है।
Isolated System: एक प्रणाली को सजातीय कहा जाता है जब उपस्थित सभी घटक एक ही चरण में होते हैं और पूरे सिस्टम में समान होते हैं।
उदाहरण के लिए: दो गलत तरल पदार्थों का मिश्रण।

Isolated System:
Homogeneous System: एक मिश्रण को विषम तब कहा जाता है जब इसमें दो या अधिक चरण होते हैं और रचना एक समान नहीं होती है।
उदाहरण के लिए: पानी में अघुलनशील ठोस का मिश्रण।
Heterogeneous system: एक थर्मोडायनामिक प्रणाली की स्थिति का अर्थ है उसके स्थूल या थोक गुण जिन्हें राज्य चर द्वारा वर्णित किया जा सकता है:
दबाव (P), आयतन (V), तापमान (T) और राशि (n) आदि।
उन्हें राज्य कार्यों के रूप में भी जाना जाता है।
Isothermal process: जब ऑपरेशन निरंतर तापमान पर किया जाता है, तो प्रक्रिया को इज़ोटेर्माल कहा जाता है। आइसोथर्मल प्रक्रिया के लिए, dT = 0 जहाँ dT तापमान में परिवर्तन होता है।
Adiabatic process: यह एक ऐसी प्रक्रिया है जिसमें सिस्टम और परिवेश के बीच गर्मी का कोई हस्तांतरण नहीं होता है।
Isobaric process: जब इस प्रक्रिया को निरंतर दबाव में किया जाता है, तो इसे आइसोबेरिक कहा जाता है।
dP = 0
Isochoric process: एक प्रक्रिया जब निरंतर मात्रा में की जाती है, तो इसे प्रकृति में आइसोकोरिक के रूप में जाना जाता है।
Cyclic process: यदि कोई प्रणाली परिवर्तनों की एक श्रृंखला से गुजरती है और अंत में अपनी प्रारंभिक स्थिति में लौटती है, तो इसे चक्रीय प्रक्रिया कहा जाता है।
प्रतिवर्ती प्रक्रिया: जब किसी प्रक्रिया में, एक परिवर्तन इस तरह से लाया जाता है कि प्रक्रिया किसी भी समय, एक असीम परिवर्तन से उलट हो सकती है। परिवर्तन r को प्रतिवर्ती कहा जाता है।
• Internal Energy For ncert solutions for class 11 chemistry chapter 6
यह ऊर्जा के सभी रूपों का योग है जो एक प्रणाली के पास हो सकती है।
ऊष्मप्रवैगिकी में, इसे एएम द्वारा निरूपित किया जाता है जो बदल सकता है, जब
- हीट सिस्टम में या बाहर से गुजरता है
- काम सिस्टम पर या उसके द्वारा किया जाता है
- पदार्थ प्रणाली में प्रवेश करता है या छोड़ता है।
Change in Internal Energy by Doing Work
हम काम करके आंतरिक ऊर्जा में बदलाव लाएं।
बता दें कि सिस्टम की प्रारंभिक स्थिति स्टेट ए और टेंप है।
TA Internal energy = uA
एक यांत्रिक कार्य करने पर नए राज्य को राज्य B और अस्थायी कहा जाता है। टी.बी. यह पाया जाता है
TB > TA
यूबी परिवर्तन के बाद की आंतरिक ऊर्जा है।
Δu = uB – uA
Change in Internal Energy by Transfer of Heat
एक सिस्टम की आंतरिक ऊर्जा को काम किए बिना आसपास के सिस्टम से गर्मी के हस्तांतरण द्वारा बदला जा सकता है।
Δu = q
जहां q सिस्टम द्वारा अवशोषित गर्मी है। इसे तापमान के अंतर के आधार पर मापा जा सकता है।
जब तापमान परिवेश से सिस्टम में स्थानांतरित हो जाता है तब q + ve होता है। जब गर्मी को सिस्टम से परिवेश में स्थानांतरित किया जाता है तो q होता है।
जब राज्य का परिवर्तन कार्य और गर्मी हस्तांतरण दोनों द्वारा किया जाता है।
Δu = q + w
ऊष्मप्रवैगिकी का पहला कानून (ऊर्जा संरक्षण का कानून)। यह बताता है कि, ऊर्जा न तो बनाई जा सकती है और न ही नष्ट की जा सकती है। एक पृथक प्रणाली की ऊर्जा निरंतर है।
Δu = q + w.
• Work (Pressure-volume Work) For class 11 chemistry chapter 6
आइए एक सिलेंडर पर विचार करें जिसमें एक आदर्श गैस का एक मोल होता है जिसमें एक घर्षण रहित पिस्टन फिट होता है

Work 
Work in ch 6 chemistry class 11
आदर्श गैस के Isothermal और प्रतिवर्ती विस्तार में काम किया

Isothermal and Reversible Expansion of Ideal Gas
• Isothermal and Free Expansion of an Ideal Gas
vacuum W = 0 में एक आदर्श गैस के इज़ोटेर्माल विस्तार के लिए

Free Expansion of an Ideal Gas
• Enthalpy (H) For chemistry class 11 ncert solutions chapter 6
इसे सिस्टम की कुल गर्मी सामग्री के रूप में परिभाषित किया गया है। यह आंतरिक ऊर्जा और दबाव-मात्रा के काम के योग के बराबर है।
गणितीय रूप से, H = U + PV
Change in enthalpy: थैलेपी में परिवर्तन उष्मा द्वारा अवशोषित या निरंतर दबाव पर प्रणाली द्वारा विकसित किया जाता है।
ΔH = qp
एक्सोथर्मिक प्रतिक्रिया के लिए (सिस्टम चारों ओर ऊर्जा खो देता है),
ΔH और qp दोनों हैं -Ve।
एंडोथर्मिक प्रतिक्रिया के लिए (सिस्टम चारों ओर से ऊर्जा को अवशोषित करता है)।
ΔH और qp दोनों + वे हैं।

thermodynamics chemistry notes
- Extensive property notes for thermodynamics in Hindi
एक व्यापक संपत्ति एक संपत्ति है जिसका मूल्य प्रणाली में मौजूद पदार्थ की मात्रा या आकार पर निर्भर करता है।
उदाहरण के लिए: द्रव्यमान, आयतन, थैलेपी आदि को व्यापक संपत्ति के रूप में जाना जाता है।
• Intensive property
गहन गुण पदार्थ के आकार या प्रणाली में मौजूद पदार्थ की मात्रा पर निर्भर नहीं करते हैं।
उदाहरण के लिए: तापमान, घनत्व, दबाव आदि को गहन गुण कहा जाता है।
• Heat capacity
तापमान में वृद्धि हस्तांतरित ताप के समानुपाती होती है।
q = coeff. x ΔT
q = CΔT
जहां, गुणांक C को ऊष्मा क्षमता कहा जाता है।
C पदार्थ की मात्रा के सीधे आनुपातिक है।
Cm = C/n
यह पदार्थ के 1 मोल की ऊष्मा क्षमता है।
• Molar heat capacity
इसे किसी पदार्थ का तापमान 1 ° (केल्विन या सेल्सियस) बढ़ाने के लिए आवश्यक ऊष्मा की मात्रा के रूप में परिभाषित किया गया है।
• Specific Heat Capacity
इसे किसी पदार्थ के एक इकाई द्रव्यमान का तापमान 1 ° (केल्विन या सेल्सियस) बढ़ाने के लिए आवश्यक ऊष्मा के रूप में परिभाषित किया गया है।
q = C x m x ΔT
जहाँ पदार्थ का m = द्रव्यमान
ΔT = तापमान में वृद्धि।
• Relation Between Cp and Cv for an Ideal Gas Fop notes for thermodynamics in Hindi
निरंतर मात्रा में ताप क्षमता = Cv
निरंतर दबाव ताप क्षमता = Cp
निरंतर मात्रा में qv = CvΔT = .U
निरंतर दबाव पर qp = Cp ΔT = =H
एक आदर्श गैस के एक मोल के लिए
ΔH = ΔU + Δ (PV) = +U + RT (RT)
ΔH = ΔU + RΔT
AndH और theu के मूल्यों को प्रतिस्थापित करने पर, समीकरण को संशोधित किया जाता है
Cp =T = CvΔT + R .T
या
Cp-Cv = R
• Measurement of ΔU and ΔH—Calorimetry
InationU का निर्धारण: isU को एक विशेष प्रकार के कैलोरीमीटर में मापा जाता है, जिसे बम कैलोरीमीटर कहा जाता है।

thermodynamics notes pdf
कैलोरीमीटर के साथ काम करना। कैलोरीमीटर में एक मजबूत पोत होता है जिसे बम (बम) कहा जाता है, जो बहुत उच्च दबाव का सामना कर सकता है। यह सुनिश्चित करने के लिए पानी के स्नान से घिरा हुआ है कि आसपास कोई भी गर्मी न हो।
Procedure: दहनशील पदार्थ का एक ज्ञात द्रव्यमान स्टील बम में शुद्ध डाइऑक्सीजन के दबाव में जलाया जाता है। प्रतिक्रिया के दौरान विकसित गर्मी को पानी में स्थानांतरित किया जाता है और इसके तापमान पर नजर रखी जाती है।

class 11 chemistry chapter 6
• Enthalpy Changes During Phase Transformation
संलयन का आंत्रशोथ: संलयन का आंत्रशोथ एक ऊष्मा ऊर्जा है या जब इसके पिघलने बिंदु पर एक ठोस के एक मोल को तरल अवस्था में परिवर्तित किया जाता है, तो थैलीसी में परिवर्तन होता है।

Enthalpy Changes During Phase Transformation
वाष्पीकरण की एन्टैलीपी: इसे उष्मा ऊर्जा के रूप में परिभाषित किया जाता है या जब इसके उबलते बिंदु पर तरल का एक मोल गैसीय अवस्था में बदल जाता है।

class 11 chemistry chapter 6 ncert solutions
Enthalpy of Sublimation: उच्च बनाने की क्रिया की तापीय धारिता को ऊष्मा ऊर्जा में परिवर्तन या थैलीपी में परिवर्तन के रूप में परिभाषित किया जाता है जब ठोस का एक मोल सीधे उसके गलनांक से नीचे के तापमान पर गैसीय अवस्था में परिवर्तित हो जाता है।
• Standard Enthalpy of Formation for thermodynamics notes pdf :-
गठन की एनथेल्पी को 298K पर तापमान की मानक स्थितियों और 1 एटीएम दबाव में इसके गठन तत्वों से किसी पदार्थ के 1 मोल के गठन में थैलेपी में परिवर्तन के रूप में परिभाषित किया गया है।

thermodynamics chemistry notes
Enthalpy of Combustion: इसे ऊष्मा ऊर्जा के रूप में परिभाषित किया जाता है या थैलीपी में परिवर्तन होता है जो वायु या ऑक्सीजन के अतिरिक्त किसी पदार्थ के 1 मोल के दहन के साथ होता है।

Enthalpy of Combustion:
• Thermochemical Equation
संतुलित रासायनिक समीकरण ΔrH के मान और अभिकारकों और उत्पादों की भौतिक अवस्था को थर्मोकेमिकल समीकरण के रूप में जाना जाता है।

Thermochemical Equation
Conventions regarding thermochemical equations
1. एक संतुलित थर्मोकैमिकल समीकरण में गुणांक अभिकर्मकों और प्रतिक्रिया में शामिल उत्पादों के मोल्स की संख्या को संदर्भित करता है।

thermodynamics chemistry notes
• Hess’s Law of Constant Heat Summation
किसी प्रतिक्रिया में उष्मा की कुल मात्रा विकसित या अवशोषित होती है, चाहे प्रतिक्रिया एक चरण में हो या कितने चरणों में हो।

Hess’s Law of Constant Heat Summation
• Born-Haber Cycle For ncert solutions for class 11 chemistry chapter 6
प्रत्यक्ष प्रयोग द्वारा आयनिक यौगिक के जालीदार थैली को निर्धारित करना संभव नहीं है। इस प्रकार, इसकी गणना निम्नलिखित चरणों द्वारा की जा सकती है। इन चरणों को दिखाने वाले आरेख को बोर्न-हैबर साइकिल के रूप में जाना जाता है।
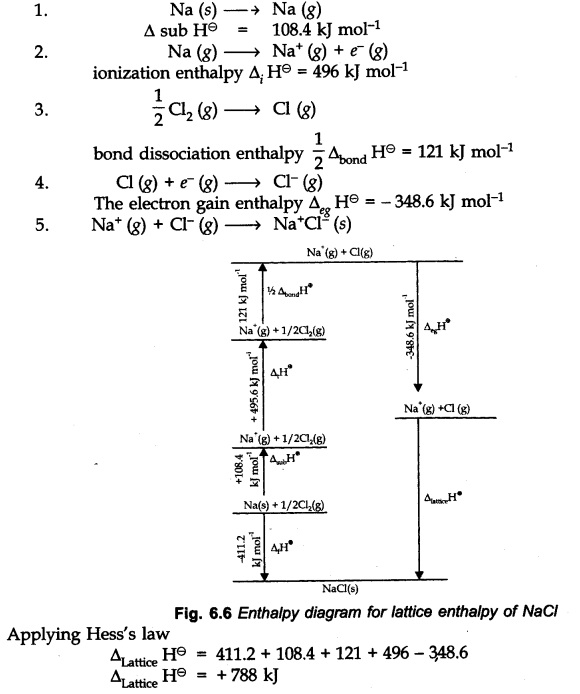
class 11 chemistry chapter 6
• Spontaneity
Spontaneous Process: एक प्रक्रिया जो स्वयं हो सकती है या होने की प्रवृत्ति होती है उसे सहज प्रक्रिया कहा जाता है।
सहज प्रक्रिया को तात्कालिक नहीं होना चाहिए। इसकी वास्तविक गति बहुत धीमी से काफी तेज भिन्न हो सकती है।
A few examples of spontaneous process are:
(i) आम नमक अपने आप पानी में घुल जाता है।
(ii) कार्बन मोनोऑक्साइड अपने स्वयं के कार्बन डाइऑक्साइड को ऑक्सीकृत करता है।
• Entropy (S)
एन्ट्रापी एक प्रणाली की यादृच्छिकता या विकार की डिग्री का एक उपाय है। किसी पदार्थ का प्रवेश ठोस अवस्था में न्यूनतम होता है जबकि यह गैसीय अवस्था में अधिकतम होता है।
सहज प्रक्रिया में एन्ट्रापी में परिवर्तन को yS के रूप में व्यक्त किया जाता है

Entropy
• Gibbs Energy and Spontaneity
एक नया थर्मोडायनामिक फ़ंक्शन, गिब्स ऊर्जा या गिब्स फ़ंक्शन जी, जी = एच-टीएस के रूप में परिभाषित किया जा सकता है
ΔG = ΔH – TΔS
गिब्स ऊर्जा परिवर्तन = थैलेपी परिवर्तन - तापमान x एन्ट्रापी परिवर्तन aG निरंतर दबाव और तापमान पर सहजता के लिए एक मानदंड देता है, (i) यदि isG नकारात्मक है (<0) तो प्रक्रिया सहज है।
(ii) यदि isG सकारात्मक है (> 0) तो प्रक्रिया गैर-स्वतःस्फूर्त है।
प्रतिवर्ती प्रतिक्रिया में मुक्त ऊर्जा परिवर्तन
chemistry chapter 6 class 11
 |
| thermodynamics notes pdf |











No comments:
Post a Comment