ncert solutions for class 11 chemistry chapter 7
equilibrium class 11 notes in Hindi
• Chemical Equilibrium
एक रासायनिक प्रतिक्रिया में रासायनिक संतुलन को उस स्थिति के रूप में परिभाषित किया जाता है, जिस पर अभिकारकों और उत्पादों की एकाग्रता में कोई और परिवर्तन नहीं होता है।
उदाहरण के लिए,
 |
| class 11 biology chapter 7 notes in hindi |
संतुलन पर आगे की प्रतिक्रिया की दर पिछड़ी प्रतिक्रिया की दर के बराबर होती है। संतुलन मिश्रण: संतुलन अवस्था में अभिकारकों और उत्पादों के मिश्रण को संतुलन मिश्रण कहा जाता है।
संतुलन की स्थिति तक पहुंचने के लिए प्रतिक्रियाओं की सीमा के आधार पर, इन्हें तीन समूहों में वर्गीकृत किया जा सकता है:
(i) जो प्रतिक्रियाएँ लगभग पूरी हो चुकी हैं और जो प्रतिक्रियावादी शेष हैं उनकी सांद्रता नगण्य है।
(ii) ऐसी प्रतिक्रियाएँ जिनमें अधिकांश अभिकारक अपरिवर्तित रहते हैं, अर्थात् केवल थोड़ी मात्रा में उत्पाद बनते हैं।
(iii) ऐसी प्रतिक्रियाएँ जिनमें अभिकारक और उत्पाद दोनों की सांद्रता तुलनीय होती है जब प्रणाली संतुलन में होती है।
• Equilibrium in Physical Processes
(i) सॉलिड-लिक्विड इक्विलिब्रियम: इक्विलिब्रियम का प्रतिनिधित्व किया जाता है
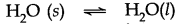 |
| class 11 chemistry chapter 7 ncert solutions |
बर्फ के पिघलने की दर = पानी के जमने की दर।
यहां प्रणाली गतिशील संतुलन में है और निम्नलिखित का अनुमान लगाया जा सकता है।
(a) दोनों विरोधी प्रक्रियाएँ एक साथ होती हैं
(b) दोनों प्रक्रियाएँ एक ही दर पर होती हैं ताकि बर्फ और पानी की मात्रा स्थिर रहे।
(ii) Liquid-Vapour Equilibrium
संतुलन का प्रतिनिधित्व किया जा सकता है
 |
| Liquid-Vapour Equilibrium |
वाष्पीकरण की दर = संक्षेपण की दर
जब तरल और वाष्प के बीच संतुलन होता है, तो इसे तरल-वाष्प संतुलन कहा जाता है।
(iii) Solid-Vapour Equilibrium
इस प्रकार के संतुलन की प्राप्ति होती है जहाँ ठोस पदार्थ वाष्प की अवस्था में होते हैं। उदाहरण के लिए, जब ठोस आयोडीन को एक बंद बर्तन में रखा जाता है, तो वायलेट के वाष्प उस बर्तन में दिखाई देने लगते हैं, जिसकी तीव्रता समय के साथ बढ़ती जाती है और अंततः यह स्थिर हो जाती है।
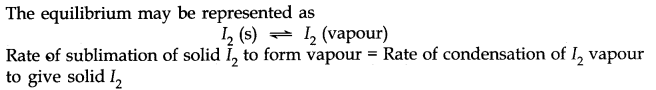 |
| Solid-Vapour Equilibrium |
• Equilibrium involving Dissolution of Solid in Liquid For chapter 7 physics class 11 notes:-
समाधान: जब नमक या चीनी या किसी भी घोल में सीमित मात्रा में पानी घोल दिया जाता है।
किसी दिए गए तापमान पर पहुंच जाता है जब कोई अधिक विलेय भंग नहीं किया जा सकता है तो समाधान को संतृप्त समाधान कहा जाता है।
एक ठोस और इसके समाधान के बीच संतुलन को संतृप्त समाधान द्वारा इंगित किया जाता है और इसे इस रूप में दर्शाया जा सकता है
 |
| involving Dissolution of Solid in Liquid |
यहाँ एक ही गति के साथ विघटन और वर्षा होती है।
संतृप्त घोल में थोड़ी मात्रा में रेडियोधर्मी चीनी मिलाने पर यह पता चलेगा कि घोल में मौजूद चीनी के साथ-साथ ठोस अवस्था में भी रेडियोधर्मी है।
• Equilibrium between a Gas and its Solution in Liquid
इस प्रकार के संतुलन को निम्न उदाहरण द्वारा देखा जा सकता है:
आइए हम एक सील सोडा पानी की बोतल पर विचार करें जिसमें उच्च दबाव में C02 गैस भंग होती है। गैस के घोल और वाष्प में मौजूद CO2 के बीच संतुलन की स्थिति प्राप्त होती है।
 |
| Equilibrium between a Gas and its Solution in Liquid |
class 11 chemistry chapter 7 ncert solutions for Henry’s law: एक निश्चित तापमान पर एक तरल में गैस की घुलनशीलता हेनरी के नियम द्वारा शासित होती है। यह बताता है कि किसी भी तापमान पर एक विलायक के दिए गए द्रव्यमान में घुलने वाली गैस का द्रव्यमान, विलायक की सतह के ऊपर गैस के दबाव के समानुपाती होता है।
 |
chemistry class 11 chapter 7 ncert solutions |
शारीरिक प्रक्रियाओं को शामिल करते हुए इक्विलिब्रिया के लक्षण
(i) संतुलन किसी दिए गए तापमान पर केवल बंद सिस्टम में ही प्राप्त किया जा सकता है।
(ii) संतुलन में प्रणाली के मापन योग्य गुण स्थिर रहते हैं।
(iii) आगे और पीछे दोनों प्रक्रिया समान दर पर होने से संतुलन गतिशील है।
(iv) संतुलन पर, पदार्थों का सांद्रण स्थिर तापमान पर स्थिर हो जाता है।
(v) संतुलन स्थिरांक का मान उस सीमा का प्रतिनिधित्व करता है जिससे संतुलन प्राप्त करने से पहले प्रक्रिया आगे बढ़ती है।
• Equilibrium in Chemical Processes For ch 7 chemistry class 11 notes
भौतिक प्रणालियों में संतुलन की तरह यह रासायनिक प्रक्रिया में भी प्राप्त किया जा सकता है जिसमें बंद कंटेनर में किए गए प्रतिवर्ती रासायनिक प्रतिक्रियाएं शामिल हैं।
 |
| Equilibrium in Chemical Processes |
रासायनिक संतुलन की गतिशील प्रकृति को हैबर की प्रक्रिया द्वारा अमोनिया के संश्लेषण में प्रदर्शित किया जा सकता है।
उच्च तापमान और दबाव पर N2 and H2 की ज्ञात मात्रा के साथ हैबर ने अपना प्रयोग शुरू किया। समय के नियमित अंतराल पर उन्होंने उपस्थित अमोनिया की मात्रा निर्धारित की। उन्होंने अप्राप्त एन 2 और एच 2 की एकाग्रता का भी पता लगाया।
एक निश्चित समय के बाद उन्होंने पाया कि मिश्रण की संरचना अभी भी बनी हुई है, जबकि कुछ रिएक्टेंट्स अभी भी मौजूद हैं। यह स्थिरता संतुलन की प्राप्ति को इंगित करती है। सामान्य तौर पर, प्रतिवर्ती प्रतिक्रिया के लिए रासायनिक संतुलन द्वारा दिखाया जा सकता है
 |
| chemical equilibria |
एक निश्चित समय के बाद दोनों प्रतिक्रियाएं एक ही दर पर होती हैं और प्रणाली संतुलन की स्थिति में पहुंच जाती है। यह दिए गए आंकड़े से दिखाया जा सकता है।
 |
| equilibrium class 11 notes |
• Equilibrium in Homogeneous System for equilibrium class 11 notes
जब किसी प्रणाली में प्रतिवर्ती प्रतिक्रिया शामिल होती है, तो अभिकारक और उत्पाद एक ही चरण में होते हैं, तो सिस्टम को समरूप प्रणाली कहा जाता है।
उदाहरण के लिए,
 |
| Equilibrium in Homogeneous System |
कुछ समय बाद यह देखा जा सकता है कि एक संतुलन बना है। संतुलन को प्रतिक्रिया मिश्रण के रंग में गति द्वारा देखा जा सकता है।
 |
| chemical equilibrium class 11 notes |
• Law of Chemical Equilibrium ncert solutions for class 11 chemistry chapter 7
एक स्थिर तापमान पर, एक रासायनिक प्रतिक्रिया की दर सीधे संतुलित रासायनिक समीकरण द्वारा दर्शाए अनुसार संबंधित stoichiometric गुणांक के बराबर एक शक्ति के लिए उठाया अभिकारक के दाढ़ सांद्रता के उत्पाद के लिए आनुपातिक है। आइए हम प्रतिक्रिया पर विचार करें,
 |
| equilibrium chemistry class 11 notes |
• इक्विलिब्रियम निरंतर K, प्रतिक्रिया भागफल Q और गिब्स ऊर्जा G के बीच संबंध।
संतुलन के थर्मोडायनामिक दृष्टिकोण की गणितीय अभिव्यक्ति का वर्णन टाइन समीकरण द्वारा किया जा सकता है।
 |
chemical equilibrium notes pdf |
 |
| class 11 chemistry chapter 7 ncert solutions |
• Factors Affecting Equilibria in class 11 chemistry chapter 7 notes
Le Chatelier’s principle: यदि संतुलन के तहत एक प्रणाली को तापमान, दबाव या एकाग्रता में परिवर्तन के अधीन किया जाता है, तो संतुलन इस तरह से बदल जाता है कि परिवर्तन के प्रभाव को कम करने या उसका प्रतिकार कर सके।
Effect of Change of Concentration: जब किसी प्रतिक्रिया या उत्पादों की किसी सन्तुलन में प्रतिक्रिया में सांद्रता को परिवर्तित किया जाता है, तो सन्तुलन की रचना बदल जाती है ताकि प्रभाव को कम से कम किया जा सके।
Effect of Pressure Change
यदि गैसीय अभिकारकों और उत्पादों के मोल्स की संख्या समान है, तो दबाव का कोई प्रभाव नहीं होता है।
जब गैसीय अभिकारकों के मोल्स की कुल संख्या और गैसीय उत्पादों की कुल संख्या अलग-अलग होती है।
बढ़ते दबाव पर, प्रति इकाई आयतन की कुल संख्या बढ़ जाती है, इस प्रकार संतुलन उस दिशा में शिफ्ट हो जाएगा जिसमें प्रति इकाई आयतन की मात्रा कम होगी।
यदि उत्पादों के मोल्स की कुल संख्या अभिकारकों के मोल्स की कुल संख्या से अधिक है, तो कम दबाव आगे की प्रतिक्रिया का पक्ष लेगा।
यदि अभिकारकों के मोल्स की कुल संख्या उत्पादों के मोल्स की कुल संख्या से अधिक है, तो उच्च दबाव फॉरवर्ड रिएक्शन के अनुकूल है।
Effect of Inert Gas Addition For equilibrium chapter class 11
यदि मात्रा स्थिर रखी जाती है तो एक अक्रिय गैस के जुड़ने के बाद संतुलन पर कोई प्रभाव नहीं पड़ता है।
कारण: ऐसा इसलिए है क्योंकि स्थिर आयतन पर अक्रिय गैस के जुड़ने से आंशिक दबाव या दाढ़ की सघनता नहीं बदलती है।
प्रतिक्रिया भागफल केवल तभी बदल जाता है जब जोड़ा गैस प्रतिक्रिया में शामिल होता है।
Effect of Temperature Change
जब सिस्टम का तापमान बदला (बढ़ा या घटा) होता है, तो परिवर्तन के प्रभाव को बेअसर करने के लिए संतुलन विपरीत दिशा में बदल जाता है। एक्ज़ोथिर्मिक प्रतिक्रिया में कम तापमान आगे की प्रतिक्रिया का पक्षधर है, जैसे,
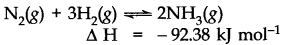 |
| ch 7 chemistry class 11 notes |
लेकिन व्यावहारिक रूप से बहुत कम तापमान प्रतिक्रिया को धीमा कर देता है और इस प्रकार एक उत्प्रेरक का उपयोग किया जाता है। एंडोथर्मिक प्रतिक्रिया के मामले में, तापमान में वृद्धि एंडोथर्मिक प्रतिक्रिया की दिशा में संतुलन को स्थानांतरित कर देगी।
Effect of a Catalyst:-
एक प्रतिक्रिया मिश्रण के संतुलन रचना पर उत्प्रेरक का कोई प्रभाव नहीं है।
कारण: चूंकि उत्प्रेरक प्रतिवर्ती प्रतिक्रिया में आगे और पीछे दोनों प्रतिक्रियाओं की गति को एक ही सीमा तक बढ़ाता है।
• Ionic Equilibrium in Solution For equilibrium class 11 notes :-
इलेक्ट्रोलाइट्स: वे पदार्थ जो अपने जलीय घोल में विद्युत प्रवाहित करते हैं।
Strong Electrolytes: वे इलेक्ट्रोलाइट्स जो पानी में विघटित होते हैं, लगभग पूरी तरह से आयनित होते हैं, उन्हें मजबूत इलेक्ट्रोलाइट्स कहा जाता है।
Weak electrolyte:वे इलेक्ट्रोलाइट्स जो पानी में आंशिक रूप से विघटित हो जाते हैं, उन्हें कमजोर इलेक्ट्रोलाइट कहा जाता है।
Ionic Equilibrium: आयनों और संघीकृत पदार्थ के बीच बनने वाले संतुलन को आयनिक संतुलन कहा जाता है, उदा।
 |
| ncert solutions for class 11 chemistry chapter 7 |
Acids: एसिड वे पदार्थ होते हैं जो नीले लिटमस पेपर को लाल कर देते हैं और कुछ धातुओं के साथ प्रतिक्रिया करने पर डायहाइड्रोजेन को मुक्त करते हैं।
Bases: पदार्थ वे पदार्थ होते हैं जो लाल लिटमस पेपर को नीला कर देते हैं। यह स्वाद में कड़वा होता है। आम उदाहरण: NaOH, Na2C03।
• Arrhenius Concept of Acids and Bases
Acids: अरहेनियस सिद्धांत के अनुसार, अम्ल ऐसे पदार्थ हैं जो हाइड्रोजन आयनों H + (aq) को देने के लिए पानी में घुल जाते हैं।
मामले: गैस पदार्थ हैं जो पानी में पृथक्करण के बाद OH- (aq) का उत्पादन करते हैं।
 |
| equilibrium chemistry class 11 notes |
• Limitations of the Arrhenius Concept
(i) अरहेनियस अवधारणा के अनुसार, एक अम्ल पानी में H + आयन देता है लेकिन H + आयन स्वतंत्र रूप से अपने बहुत छोटे आकार (~ H-18 m त्रिज्या) और तीव्र विद्युत क्षेत्र के कारण मौजूद नहीं है।
(ii) इसमें अमोनिया जैसे पदार्थों की मौलिकता का हिसाब नहीं है, जिसमें हाइड्रॉक्सिल समूह नहीं है।
• The Bronsted-Lowry Acids and Bases for class 11 equilibrium notes
ब्रोंस्टेड-लोरी के अनुसार, एक एसिड एक पदार्थ है जो हाइड्रोजन आयन एच + को दान करने में सक्षम है और आधार एक हाइड्रोजन आयन एच + को स्वीकार करने में सक्षम पदार्थ हैं।
दूसरे शब्दों में, एसिड प्रोटॉन दाता हैं और आधार प्रोटॉन स्वीकर्ता हैं। इसे निम्नलिखित उदाहरण द्वारा समझाया जा सकता है।
 |
| equilibrium chemistry class 11 notes pdf |
• Acid and Base as Conjugate Pairs
एसिड-बेस जोड़ी जो केवल एक प्रोटॉन से भिन्न होती है, एक संयुग्मित एसिड-बेस जोड़ी कहलाती है।
आइए हम पानी में HCL के आयनीकरण के उदाहरण पर विचार करें।
 |
| HCL ion |
यहाँ पानी एक आधार के रूप में कार्य करता है क्योंकि यह प्रोटॉन को स्वीकार करता है।
CL, HCl का एक संयुग्मित आधार है और HCl, आधार CL का संयुग्म अम्ल है। इसी तरह, H2O एक एसिड H30+ का आधार है और H30+ आधार H2O का एक संयुग्मित अम्ल है।
• Lewis Acids and Bases For ionic equilibrium notes
लुईस के अनुसार, एसिड एक पदार्थ है जो इलेक्ट्रॉन जोड़े को स्वीकार करता है और आधार एक इलेक्ट्रॉन जोड़ी को दान करने वाला पदार्थ है।
इलेक्ट्रॉन की कमी वाली प्रजातियाँ जैसे AlCl3, BH3, H+ आदि लुईस एसिड के रूप में कार्य कर सकती हैं जबकि H20, NH3 आदि प्रजातियाँ इलेक्ट्रॉनों की एक जोड़ी दान कर सकती हैं, लुईस अड्डों के रूप में कार्य कर सकती हैं।
• Ionization of Acids and Bases
जलीय घोल में आयनीकरण की सीमा की सहायता से अम्ल या क्षार की शक्ति निर्धारित की जाती है।
पीएच स्केल: हाइड्रोजन-आयन सांद्रता को प्रति लीटर घोल में मौजूद हाइड्रोजन आयनों के ग्राम आयनों की संख्या के रूप में मापा जाता है।
चूंकि ये सांद्रता आमतौर पर छोटे होते हैं, इसलिए एकाग्रता को आमतौर पर समाधान के पीएच के रूप में व्यक्त किया जाता है। पीएच हाइड्रोजन आयन सांद्रता के पारस्परिक का लघुगणक है।
 |
| Ionization of Acids and Bases |
• Di and Polybasic Acids
जिन अणुओं में प्रति अणु में एक से अधिक आयनीय प्रोटॉन होते हैं, उन्हें डायबेसिक एसिड या पॉलीबेसिक एसिड या पॉलीप्रोटिक एसिड कहा जाता है।
आम उदाहरण हैं ऑक्सालिक एसिड, सल्फ्यूरिक एसिड, फॉस्फोरिक एसिड आदि।
 |
| Di and Polybasic Acids |
Factors Affecting Acid Strength For ionic equilibrium notes pdf
जब एच-ए बांड की ताकत कम हो जाती है
 |
| equilibrium class 11 notes |
बंधन को तोड़ने के लिए आवश्यक ऊर्जा कम हो जाती है, एच-ए एक मजबूत एसिड बन जाता है।
जैसे-जैसे ए का आकार समूह में बढ़ता है, एच-ए बांड की ताकत कम होती जाती है और इसलिए एसिड की ताकत बढ़ जाती है।
एक अवधि में, जैसा कि ए की इलेक्ट्रोनगेटिविटी बढ़ जाती है, एसिड की ताकत बढ़ जाती है।
 |
equilibrium chemistry class 11 notes |
• Common Ion Effect in ionic equilibrium notes
यदि एक कमजोर इलेक्ट्रोलाइट के जलीय घोल में, एक मजबूत इलेक्ट्रोलाइट को कमजोर इलेक्ट्रोलाइट के साथ आयन आम जोड़ा जाता है, तो कमजोर इलेक्ट्रोलाइट का पृथक्करण कम या दबा हुआ होता है।
जिस प्रभाव से कमजोर इलेक्ट्रोलाइट का पृथक्करण होता है उसे सामान्य आयन प्रभाव के रूप में जाना जाता है।
 |
| Common Ion Effect in ionic equilibrium notes |
 |
| ionic equilibrium notes pdf |
• Solubility Products
यह विरल रूप से घुलनशील नमक पर लागू होता है। आयनों और संघीकृत ठोस पदार्थ के बीच संतुलन है।
 |
| Solubility Products |
• Equilibrium: यह भौतिक और रासायनिक दोनों प्रक्रियाओं के लिए स्थापित किया जा सकता है। आगे और पीछे की प्रतिक्रियाओं के संतुलन की स्थिति के बराबर हैं।
• Equilibrium constant: Kc को व्यक्त किया जाता है कि उत्पादों के सांद्रता को अभिकर्मकों द्वारा विभाजित किया जाता है, जिसे स्टोइकोमेट्रिक गुणांक में उठाए गए प्रत्येक शब्द से विभाजित किया जाता है। प्रतिक्रियाओं के लिए,
 |
| Equilibrium constant |
• Le Chatelier’s principle: यह बताता है कि किसी भी कारक जैसे कि तापमान, दबाव, एकाग्रता आदि में परिवर्तन, संतुलन को ऐसी दिशा में स्थानांतरित करने का कारण होगा ताकि परिवर्तन के प्रभाव को कम किया जा सके।
• • Electrolytes: वे पदार्थ जो जलीय विलयनों में विद्युत का संचालन करते हैं, इलेक्ट्रोलाइट्स कहलाते हैं।
• • Arrhenius Concept:अरहेनियस के अनुसार, अम्ल हाइड्रोजीनस देते हैं जबकि आधार उनके जलीय घोल में हाइड्रॉक्सिल आयनों का उत्पादन करते हैं।
• Bronsted-Lowry concept: ब्रोनस्टेड-लोरी ने एसिड को प्रोटॉन दाता के रूप में परिभाषित किया और एक प्रोटॉन स्वीकर्ता के रूप में एक आधार।
• Conjugate base and Conjugate acid: जब एक ब्रॉन्स्टेड-लोरी एसिड एक आधार के साथ प्रतिक्रिया करता है तो यह अपने संयुग्मित आधार और संयुग्म एसिड का उत्पादन करता है।
• Conjugate pair of acid and base: अम्ल और क्षार का संयुग्म युग्म केवल एक प्रोटॉन द्वारा भिन्न होता है।
• Lewis acids: एक इलेक्ट्रॉन जोड़ी स्वीकर्ता के रूप में एसिड को परिभाषित करें और एक इलेक्ट्रॉन जोड़ी दाता के रूप में एक आधार।
• pH Scale: दाढ़ में हाइड्रोनियम आयन सांद्रता को पीएच स्केल के रूप में जाना जाने वाले लॉगरिदमिक पैमाने पर अधिक आसानी से व्यक्त किया जाता है। शुद्ध पानी का पीएच 7 है।
• Buffer solution : यह वह घोल है जिसका पीएच मजबूत एसिड या बेस की छोटी मात्रा के अलावा नहीं बदलता है।
उदाहरण के लिए: CH3COOH + CH3COONa।
• Solubility product (Ksp): एक विरल रूप से घुलनशील नमक के लिए, इसे आयनों के दाढ़ सांद्रता के उत्पाद के रूप में परिभाषित किया जाता है, जो कि प्रत्येक आयन के लिए सोलूबाइट्स के समीकरण में होने वाली संख्या के बराबर शक्ति के बराबर होता है।
 |
| chemical equilibrium class 11 notes |










No comments:
Post a Comment