class 11 chemistry chapter 10 notes in hindi | s block elements notes in hindi
• General Electronic Configuration of s-Block Elements
क्षार धातुओं के लिए [noble gas] ns1
क्षारीय पृथ्वी धातुओं के लिए [noble gas] ns2
s block elements notes in Hindi
• Group 1 Elements: Alkali metals in Hindi
इलेक्ट्रॉनिक कॉन्फ़िगरेशन, ns1, जहां n वेलेंस शेल का प्रतिनिधित्व करता है।
इन तत्वों को क्षार धातु कहा जाता है क्योंकि वे पानी में घुलनशील हाइड्रॉक्साइड बनाने के लिए आसानी से घुल जाते हैं, जो प्रकृति में दृढ़ता से क्षारीय होते हैं।
 |
| group 1 elements |
• Atomic and Ionic Radii For chapter 10 chemistry class 11 notes
क्षार धातुओं के परमाणु और आयनिक त्रिज्या समूह को नीचे ले जाने पर बढ़ते हैं, अर्थात, वे Li से Cs तक जाने वाले आकार में बढ़ जाते हैं। क्षार धातुएं एक वैलेंस इलेक्ट्रॉन को खो कर मोनोवालेंट केशन बनाती हैं। इस प्रकार जनक परमाणु की तुलना में cationic त्रिज्या कम है।
• Ionization Enthalpy in Hindi
क्षार धातुओं की आयनीकरण थैलेपीज़ आम तौर पर कम होती हैं और ली से सीएसएस तक समूह को कम करती हैं।
कारण: चूंकि क्षार धातुओं में बड़े परमाणु आकार होते हैं, जिसके परिणामस्वरूप वैलेंस एस-इलेक्ट्रॉन (ns1) को आसानी से हटाया जा सकता है। बढ़े हुए परमाणु रेडी और स्क्रीनिंग प्रभाव के कारण नाभिक के साथ आकर्षण बल के परिमाण में कमी के कारण ये मूल्य समूह को कम करते हैं।
hydration enthalpy in Hindi
आयन का आकार जितना छोटा होता है, उसकी हाइड्रेटेड होने की प्रवृत्ति उतनी ही अधिक होती है इसलिए अधिक हाइड्रेशन थैलेपी होता है।
क्षार धातु के आयनों के जलयोजन थैलपिस आयनिक आकारों में वृद्धि के साथ घटते हैं।
Li+ > Na+ > K+ > Rb+ > Cs+
• Physical Properties For alkali metals
(i) सभी क्षार धातुएँ सफेद, मुलायम और हल्की धातुएँ हैं।
(ii) उनके पास आम तौर पर कम घनत्व होता है जो समूह को बढ़ाता है।
(iii) वे एक ऑक्सीकरण लौ में रंग प्रदान करते हैं। इसका कारण यह है कि लौ से निकलने वाली ऊष्मा सबसे बाहरी कक्षीय इलेक्ट्रॉन को उच्च ऊर्जा स्तर तक उत्तेजित करती है। जब उत्तेजित इलेक्ट्रॉन वापस जमीन पर आता है, तो दृश्य क्षेत्र में विकिरण का उत्सर्जन होता है।
• Chemical Properties of Alkali Metals
(i) Reaction with air For alkali metals in class 11 chemistry chapter 10 notes:
जब क्षार धातुओं की हवा की सतह के संपर्क में आक्साइड और हाइड्रॉक्साइड के गठन के कारण धूमिल हो जाते हैं।
क्षार धातुएं अपनी प्रकृति के आधार पर अलग-अलग ऑक्साइड बनाने के लिए हीटिंग पर ऑक्सीजन के साथ जोड़ती हैं।
 |
| Reaction with air |
(ii) Reaction with water:
क्षार धातु हाइड्रॉक्साइड और डायहाइड्रोजेन बनाने के लिए पानी के साथ प्रतिक्रिया करते हैं
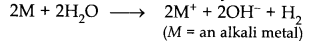 |
| Reaction with water |
(iii) Reaction with hydrogen:
क्षार धातु हाइड्रोजन के साथ मिलकर 673 K (1073 K पर लिथियम) के साथ हाइड्राइड बनाते हैं।
2M + H2 ————-> 2M+
हाइड्राइड्स का आयनिक चरित्र Li से Cs तक बढ़ जाता है।
(iv) Reaction with halogens:
क्षार धातु के हलोजन के साथ मिलकर सीधे धातु हलाइड बनाते हैं।
2M + X2————–> 2MX
उनके पास उच्च पिघलने और क्वथनांक हैं।
एम की प्रतिक्रियाशीलता का क्रम:
| Reaction with hydrogen |
(v) Reducing nature:
क्षार धातु मजबूत कम करने वाले एजेंट हैं। जलीय घोल में यह देखा गया है कि क्षार धातुओं का कम करने वाला वर्ण क्रम से अनुसरण करता है Na <K <Rb <Cs <Li, Li सबसे मजबूत है जबकि सोडियम कम से कम शक्तिशाली एजेंट है। इसे इलेक्ट्रोड क्षमता (ई °) के संदर्भ में समझाया जा सकता है। चूंकि ली की इलेक्ट्रोड क्षमता सबसे कम है। इस प्रकार ली सबसे मजबूत कम करने वाला एजेंट है।
(vi) Solubility in liquid ammonia:
गहरे नीले घोल देने के लिए क्षार धातु तरल अमोनिया में घुल जाती है। समाधान प्रकृति में चल रहा है।
M+ (x + y) NH3 ———-> [M (NH3) X]+ + [e (NH3) y]–
जब प्रकाश अम्मोनीकृत इलेक्ट्रॉनों पर गिरता है, तो वे लाल रंग के अनुरूप ऊर्जा को अवशोषित करते हैं और इससे निकलने वाले प्रकाश का रंग नीला होता है। केंद्रित समाधान में रंग नीले से कांस्य में बदल जाता है। नीले रंग के समाधान पैरामैग्नेटिक होते हैं जबकि केंद्रित समाधान डायमैग्नेटिक होते हैं।
Uses of Alkali Metals For chapter 10 chemistry class 11 notes
Uses of Lithium
(i) लिथियम का उपयोग तांबा और निकल की शुद्धि में डीऑक्सीडाइज़र के रूप में किया जाता है।
(ii) लिथियम का उपयोग प्राथमिक और द्वितीयक दोनों प्रकार की बैटरी बनाने के लिए किया जाता है।
(iii) मौसम संबंधी प्रयोजनों के लिए हाइड्रोजन के स्रोत के रूप में लिथियम हाइड्राइड का उपयोग किया जाता है।
(iv) लिथियम एल्यूमीनियम हाइड्राइड (LiAlH4) एक अच्छा कम करने वाला एजेंट है।
(v) ग्लास बनाने में लिथियम कार्बोनेट का उपयोग किया जाता है।
uses of sodium in Hindi
(i) प्रयोगशाला में सोडियम अमलगम (कार्बनिक यौगिकों के संश्लेषण) के रूप में उपयोग किया जाता है।
(ii) सोडियम का उपयोग सोडियम वाष्प लैंप में किया जाता है।
(iii) पिघले हुए राज्य में, इसका उपयोग परमाणु रिएक्टरों में किया जाता है।
(iv) सोडियम-पोटेशियम के एक मिश्र धातु का उपयोग उच्च तापमान थर्मोमेट्रेस में किया जाता है।
Uses of Potassium
(i) उर्वरकों में पोटेशियम के लवणों का उपयोग किया जाता है।
(ii) एजेंट को कम करने के रूप में उपयोग किया जाता है।
Uses of Cesium
(i) रॉकेट प्रोपेल में
(ii) फोटोग्राफिक कोशिकाओं में।
• Group 2 Elements: Alkaline Earth Metals :
क्षारीय पृथ्वी धातु: उन्हें क्षारीय पृथ्वी धातुओं का नाम दिया गया था क्योंकि वे क्षार धातुओं के आक्साइड की तरह प्रकृति में क्षारीय थे और वे पृथ्वी की पपड़ी में पाए गए थे।
उदाहरण, Be (बेरिलियम), Ca, Mg, Sr आदि।
• Electronic Configuration
उनके सामान्य इलेक्ट्रॉनिक कॉन्फ़िगरेशन को [महान गैस] ns2 के रूप में दर्शाया गया है।
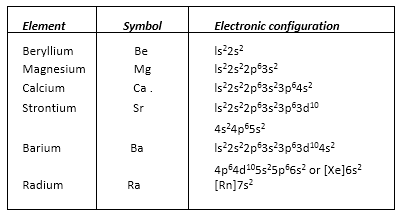 |
| Electronic Configuration |
• Atomic and Ionic Radii
क्षारीय पृथ्वी धातुओं के परमाणु और आयनिक रेडियो समूह के भीतर परमाणु और आयनिक त्रिज्या परमाणु संख्या में वृद्धि के साथ बढ़ जाती है। कारण: क्योंकि इन तत्वों में केवल दो वैलेंस इलेक्ट्रॉन होते हैं और नाभिक के साथ आकर्षण बल का परिमाण काफी छोटा होता है।
• Ionization Enthalpies
इन धातुओं में परमाणुओं के काफी बड़े आकार के कारण कम आयनीकरण वाली थैलेपीज़ भी होती हैं। जैसे-जैसे परमाणु आकार में वृद्धि होती है, वैसे-वैसे समूह आयनीकरण के थैलेपीज़ कम होते जाते हैं।
क्षार धातुओं की तुलना में उनके छोटे आकार के कारण क्षारीय पृथ्वी धातुओं के पहले आयनीकरण की थैलेपीज क्षार धातुओं की तुलना में अधिक है।
• Hydration Enthalpies in hindi
क्षारीय पृथ्वी धातु आयनों के जलयोजन थैलिपी क्षार धातुओं की तुलना में बड़े होते हैं। इस प्रकार क्षारीय पृथ्वी धातुओं में हाइड्रेट बनने की प्रवृत्ति अधिक होती है। साइटेशन आकार में वृद्धि के बाद से जलयोजन थैलेपीज़ समूह में घट जाती है।
Be2+ > Mg2+ > Ca2+ > Sr2+ > Ba2+
Metallic character: समान अवधि में क्षार धातुओं की तुलना में उनके पास मजबूत धातु बंधन होते हैं। यह क्षारीय पृथ्वी धातु के छोटे कर्नेल आकार और सबसे बाहरी खोल में मौजूद दो वैलेंस इलेक्ट्रॉनों के कारण है।
Physical Properties for Alkaline Earth Metals
(i) वे क्षार धातुओं की तुलना में कठिन हैं।
(ii) M.P और B.P अपने छोटे आकार के कारण संबंधित क्षार धातुओं से अधिक हैं।
(iii) इलेक्ट्रोपोसिटिव चरित्र समूह को बढ़ाता है।
(iv) Be और Mg को छोड़कर, ये सभी धातुएँ लौ को चारित्रिक रंग प्रदान करती हैं।
(v) क्षारीय पृथ्वी धातुओं में उच्च तापीय और विद्युत चालकता होती है।
Chemical Properties for Alkaline Earth Metals in Hindi
1. Reaction with oxygen : - उनकी सतह पर ऑक्साइड की एक पतली फिल्म के निर्माण के कारण बेरिलियम और मैग्नीशियम ऑक्सीजन की गति से अक्रिय हैं।
समूह के नीचे जाते ही ऑक्सीजन के प्रति प्रतिक्रिया बढ़ जाती है।
2. Reaction with water चूँकि ये धातुएँ क्षार धातुओं की तुलना में कम इलेक्ट्रोपोसिटिव होती हैं, इसलिए ये पानी के प्रति कम प्रतिक्रियाशील होती हैं।
मैग्नीशियम उबलते पानी या भाप के साथ प्रतिक्रिया करता है। बाकी सदस्य ठंडे पानी से भी प्रतिक्रिया करते हैं।
Mg + 2H20 ——-> Mg(OH)2 + H2
Ca + 2H20 ————> Ca(OH)2 + H2
3. Reaction with halogens. वे संबंधित तापमान MX2 बनाने के लिए उचित तापमान पर हलोजन के साथ गठबंधन करते हैं।
M + X2 ——–> MX2 (X = F, Cl, Br, I)
(NH4) का थर्मल अपघटन BeF2 की तैयारी के लिए उपयोग किया जाता है।
4. Reaction with hydrogen :- इन धातुओं को छोड़कर हाइड्रोजन के साथ मिलकर धातु हाइड्राइड्स बनाने के लिए सीधे गर्म किया जाता है।
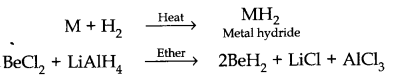 |
| Reaction with hydrogen |
• General Characteristics of Compounds of Alkaline Earth Metals
ऑक्साइड और हाइड्रॉक्साइड
(i) क्षारीय पृथ्वी धातुएँ ऑक्सीजन में एमओ (मोनोऑक्साइड) बनाती हैं।
(ii) ये ऑक्साइड गर्मी के लिए बहुत स्थिर होते हैं।
(iii) बीईओ प्रकृति में उभयचर है जबकि अन्य तत्वों के ऑक्साइड आयनिक हैं।
(iv) बीईओ को बाहर निकालो, वे स्वभाव से बुनियादी हैं और पानी के साथ प्रतिक्रियाशील रूप से घुलनशील हाइड्रॉक्साइड बनाते हैं।
MO + H2O ———-> M(OH)2
(v) क्षारीय पृथ्वी धातुओं के हाइड्रॉक्साइड क्षार धातु हाइड्रॉक्साइड की तुलना में कम स्थिर और कम बुनियादी होते हैं।
(vi) बेरिलियम हाइड्रॉक्साइड प्रकृति में उभयचर है।
Halides
क्षारीय पृथ्वी धातुएं हलोजन, एमएक्स 2 बनाने वाले उचित तापमान पर हैलोजेन के साथ सीधे जोड़ती हैं।
वे धातु, धातु आक्साइड, धातु हाइड्रॉक्साइड पर हलोजन एसिड (HX) की क्रिया द्वारा भी तैयार किए जा सकते हैं।
M + 2HX ——-> MX2 + H2
MO + 2HX ——> MX2 + H20
M (OH)2 + 2HX —–> MX2 + 2H20
(i) बेरिलियम हलाइड्स को छोड़कर, क्षारीय पृथ्वी धातुओं के अन्य सभी प्रकार प्रकृति में आयनिक हैं।
(ii) BeCl2 और MgCl2 को छोड़कर क्षारीय पृथ्वी धातुओं के अन्य क्लोराइड, ज्वाला में रंग भरने के लिए विशिष्ट रंग प्रदान करते हैं।
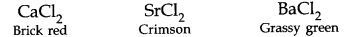 |
| s block elements class 11 notes |
(iii) हलाइड हाइड्रेट बनाने की प्रवृत्ति समूह में घट जाती है।
उदाहरण के लिए, (MgCl2- 8 H20, CaCl2- 6 H20, SrCl2– 6 H20, BaCl2- 2 H2O)
(iv) BeCl2 के ठोस चरण में एक श्रृंखला संरचना है जैसा कि नीचे दिखाया गया है।
वाष्प चरण में यौगिक एक डिमर के रूप में मौजूद होता है, जो मोनोमर देने के लिए लगभग 1000K पर विघटित होता है जिसमें बी एटम बीजाणु संकरण अवस्था में होता है।
Sulphates
(i) क्षारीय पृथ्वी धातुओं के सल्फेट्स सफेद ठोस और गर्मी के लिए काफी स्थिर होते हैं।
(ii) BeS04 और MgS04 पानी में आसानी से घुलनशील हैं। घुलनशीलता BeS04 से BaS04 तक घट जाती है।
कारण। Be2 + आयनों और Mg2 + आयनों के अधिक से अधिक जलयोजन थैलेपीज़ के कारण वे जाली थैलेपी फैक्टर को दूर करते हैं। उनके सल्फेट्स पानी में घुलनशील हैं।
Carbonates
क्षारीय पृथ्वी धातुओं के कार्बोनेट ताप पर अस्थिर और विघटित होते हैं।
 |
| Carbonates |
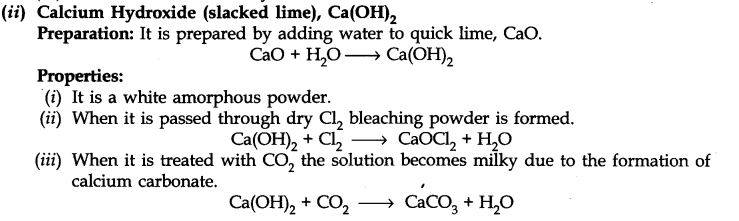
Uses ofAlkaline Earth Metals:
(i) सीमेंट, सोडियम कार्बोनेट, कैल्शियम कार्बाइड आदि के निर्माण में।
(ii) चीनी के शोधन में प्रयुक्त।
(iii) डाई के सामान के निर्माण में।
 |
| Uses |
Uses:
(i) इसका उपयोग भवन निर्माण सामग्री के निर्माण में किया जाता है।
(ii) कीटाणुनाशक के रूप में व्हाइट-वॉश में उपयोग किया जाता है।
(iii) प्रयोगशाला में C02 गैस का पता लगाने के लिए उपयोग किया जाता है।
(iii) Calcium Carbonate or Limestone (CaC03)
तैयारी: कैल्शियम कार्बोनेट प्रकृति में चूना पत्थर, संगमरमर, चाक आदि के विभिन्न रूपों में होता है। इसे C02 को सीमित मात्रा में स्लेड चूने के माध्यम से तैयार किया जा सकता है।
Ca(OH)2 + C02 ———> CaC03 + H20
यह कैल्शियम क्लोराइड के साथ सोडियम कार्बोनेट के समाधान की प्रतिक्रिया से भी तैयार किया जा सकता है।
CaCl2 + Na2C03 ————> CaC03 + 2NaCl
 |
| Calcium Carbonate or Limestone (CaC03) |
Uses:
(i) क्विक लाइम के निर्माण में।
(ii) धातुओं के निष्कर्षण में प्रवाह के रूप में MgC03 का उपयोग किया जाता है।
(iii) एंटासिड के रूप में उपयोग किया जाता है।
(iv) उच्च गुणवत्ता वाले कागज के निर्माण में।
(iv) Calcium Sulphate (Plaster of Paris) CaS04-1/2H20
Preparation: यह तब प्राप्त होता है जब जिप्सम CaS04– 2 H20 को 393 K तक गर्म किया जाता है
2(CaS04-2H20) ———-> 2(CaS04) . H20 + 3H20
ऊपर 393 K निर्जल CaS04 बनता है, जिसे 'मृत जले हुए प्लास्टर' कहा जाता है।
Properties:
(i) यह एक सफेद वायुमंडलीय पाउडर है।
(ii) जब इसे पर्याप्त मात्रा में पानी में मिलाया जाता है तो यह 15 मिनट के भीतर एक प्लास्टिक हार्ड मास बनाता है।
Uses:
(i) मिट्टी के बर्तनों, चीनी मिट्टी आदि बनाने में आमतौर पर इस्तेमाल किया जाता है।
(ii) फ्रैक्चर वाली हड्डी या मोच को स्थापित करने के लिए सर्जिकल पट्टियों में उपयोग किया जाता है।
(iii) मूर्तियाँ, सजावटी कार्य, सजावटी सामग्री आदि बनाने के लिए।
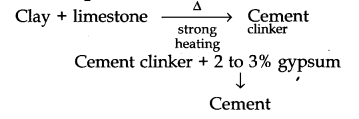
(v) Cement for s block elements class 11 notes
तैयारी: सीएओ से समृद्ध एक सामग्री को मिट्टी जैसे अन्य सामग्री के साथ मिलाकर तैयार किया जाता है, जिसमें एल्यूमीनियम, लोहा और मैग्नीशियम के आक्साइड के साथ-साथ Si02 भी शामिल है।
 |
| s block class 11 notes |
Important Ingredients of portland cement:
(Ca2Si04) dicalcium silicate 26%
(Ca2SiO4) Tricalcium silicate 51%
(Ca3Al206) Tricalcium Aluminate 11%
Uses:
पलस्तर और निर्माण उद्देश्यों में।
• s- ब्लॉक तत्व समूह I और II तत्वों का गठन करते हैं।
• का सामान्य इलेक्ट्रॉनिक विन्यास
समूह I = [नोबल गैस] ns1
समूह II = [नोबल गैस] ns2
• विकर्ण संबंध
 |
| class 11 s block elements notes |
दूसरी अवधि के पहले तीन तत्व (ली, बी, बी) तीसरी अवधि के तत्वों (मिलीग्राम, अल, सी) के साथ विकर्ण समानता दिखाते हैं। ऐसी समानताओं को विकर्ण संबंध कहा जाता है।
• क्षार धातुएँ चांदी की सफेद धातु होती हैं। वे अत्यधिक प्रतिक्रियाशील हैं। उनके जलीय घोल प्रकृति में दृढ़ता से क्षारीय होते हैं। उनके परमाणु और आयनिक आकार समूह को नीचे ले जाने पर बढ़ते हैं और आयनीकरण के थैलेपीज़ समूह में व्यवस्थित रूप से कम हो जाते हैं।
• क्षारीय पृथ्वी धातु। वे क्षार धातुओं के समान हैं लेकिन छोटे आकार के कारण कुछ अंतर हैं। उनके ऑक्साइड और हाइड्रॉक्साइड क्षार धातुओं की तुलना में कम बुनियादी हैं।
• सोडियम हाइड्रॉक्साइड (NaOH) कास्टनर- केल्नर सेल में aq NaCl के इलेक्ट्रोलिसिस द्वारा तैयार किया जाता है।
स्लेक्ड लाइम सीए (ओएच) 2 पानी पर त्वरित चूने की कार्रवाई से बनता है।
• जिप्सम CaS04 है। 2 एच 20। 390 K CaS04 / 2H20 (प्लास्टर ऑफ पेरिस) को गर्म करने पर बनता है।










No comments:
Post a Comment