p block elements class 11 notes - Chemistry Notes
class 11 chemistry chapter 11 notes
• p-Block Elements
आवर्त सारणी के समूह 13 से 18 तक के तत्वों को पी-ब्लॉक तत्व कहा जाता है। सामान्य इलेक्ट्रॉनिक कॉन्फ़िगरेशन: ns2 np1-6 (वह को छोड़कर)
 |
| p block elements class 11 notes |
Group 13 Elements: The Boron Family
Outer Electronic Configuration: ns2np1Atomic Radii For Group 13 Elements : - समूह 13 तत्वों का परमाणु और आयनिक क्षार, क्षार और क्षारीय पृथ्वी धातुओं के संगत तत्वों से छोटे होते हैं।
Reason: एक अवधि में बाएं से दाएं जाने पर प्रभावी परमाणु आवेश बढ़ता है और बाहरी इलेक्ट्रॉनों को नाभिक की ओर अधिक मजबूती से खींचा जाता है। इससे परमाणु आकार में कमी आती है।
समूह को नीचे ले जाने पर, प्रत्येक सफल तत्व के साथ एक नए इलेक्ट्रॉन शेल के जुड़ने के कारण परमाणु और आयनिक रेडी दोनों बढ़ने की उम्मीद थी।
Exception: गै की परमाणु त्रिज्या गैलियम में खराब शेड 10 डी-इलेक्ट्रॉनों की उपस्थिति के कारण अल से कम है।
Ionisation enthalpies: समूह -13 के तत्वों की पहली आयनियेशन एन्टालपीज़, समूह -२ में मौजूद तत्वों की तुलना में उसी अवधि में कम होती हैं।
Reason: पी-इलेक्ट्रॉन को हटाना एस-इलेक्ट्रॉन की तुलना में बहुत आसान है और इसलिए, समूह 13 के तत्वों के पहले आयनाइजेशन एंटेलपियों ((i H1) समूह 2 के तत्त्व तत्वों की तुलना में कम हैं।
बी से अल तक समूह 13 को नीचे ले जाने पर, परमाणु आकार और स्क्रीनिंग प्रभाव में वृद्धि के कारण पहला-आयनीकरण थैलेपीज़ (thei H1) घटता है जो वृद्धि के प्रभाव को कम करता है
परमाणु प्रभार।
अल-गा और के बीच और इन और टीएल के बीच आयनियोजन तापीय धारिता में डी-ए और एफ-इलेक्ट्रॉनों की क्षमता के कारण असंतोष की उम्मीद है, जो परमाणु चार्ज में वृद्धि की भरपाई के लिए कम स्क्रीनिंग प्रभाव डालते हैं।
Electronegativity p block elements class 11 notes: समूह के नीचे, इलेक्ट्रोनगेटिविटी पहले बी से अल तक घट जाती है और फिर बढ़ जाती है।
यह तत्वों के परमाणु आकार में विसंगतियों के कारण है।
Physical Properties For group 13 elements
(i) मजबूत क्रिस्टलीय जाली के कारण बोरान में उच्च गलनांक होता है। इस परिवार के बाकी सदस्यों में कम गलनांक है।(ii) बोरॉन प्रकृति में अत्यंत कठोर और काले रंग का ठोस और अधातु है।
(iii) इस परिवार के अन्य सदस्य कम पिघलने वाले बिंदु और उच्च विद्युत चालकता वाले नरम धातु होते हैं।
Chemical Properties for p block elements class 11
Oxidation states: पहले दो तत्व बोरान और एल्यूमीनियम यौगिकों में केवल +3 ऑक्सीकरण राज्य दिखाते हैं ~ लेकिन इस समूह गैलियम, इंडियम और थैलियम के अन्य तत्व भी +3 ऑक्सीकरण राज्य के अलावा +1 ऑक्सीकरण राज्य का प्रदर्शन करते हैं अर्थात वे चर दिखाते हैं।Oxidation states:
जब हम समूह को नीचे ले जाते हैं, तो +3 ऑक्सीकरण राज्य की स्थिरता कम हो जाती है जबकि +1 ऑक्सीकरण राज्य उत्तरोत्तर बढ़ जाता है।

notes of p block elements class 11
Physical properties of boric acid:
(i) यह एक सफेद क्रिस्टलीय ठोस है।
(ii) यह स्पर्श में नरम साबुन है।
(iii) यह ठंडे पानी में विरल रूप से घुलनशील है, लेकिन गर्म पानी में काफी घुलनशील है।
Uses:
(i) ऊष्मा प्रतिरोधी बोरोसिलिकेट ग्लेज़ के निर्माण में।
(ii) दूध और खाद्य सामग्री के लिए परिरक्षक के रूप में।
(iii) मिट्टी के बर्तनों में एनामेल्स और ग्लेज़ के निर्माण में।
Structure of boric acid for p block elements notes in hindi
 |
| p block elements class 11 |
(iii) डिबोराने, (बी 2 एच 6): हाइड्रोजन के साथ बोरोन के यौगिकों की श्रृंखला को बोरनेस के रूप में जाना जाता है।
डायथाइल ईथर में LiAlH4 के साथ बोरोन ट्राइफ्लोराइड की कमी से डिबोरेन तैयार किया जाता है।
4BF3 + 3LiAlH4 ——–> 2B2H6+ 3LiF + 3AlF3
तैयारी की प्रयोगशाला विधि। प्रयोगशाला में डिबोराने को आयोडीन के साथ सोडियम बोरोहाइड्राइड के ऑक्सीकरण द्वारा तैयार किया जाता है।
2NaBH4 + I2 ——-> B2H6 + 2NaI +H2
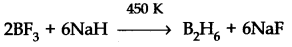
तैयारी की औद्योगिक विधि। औद्योगिक पैमाने पर, सोडियम हाइड्राइड के साथ बीएफ 3 की कमी से डिबोरेन तैयार किया जाता है।
Physical Properties For boric acid:
(i) डिबोराने एक बेरंग, अत्यधिक विषैली गैस है जिसमें बी.पी. का 180 के।
(ii) डिबोराने हवा के संपर्क में आने पर अनायास आग पकड़ लेता है।
(iii) ऊंची बोरियां अनायास हवा में ज्वलनशील होती हैं।
Chemical properties For boric acid:
(i) बोरिक एसिड बनाने के लिए बोरनेस को पानी द्वारा आसानी से हाइड्रोलाइज किया जाता है
B2H6(g) + 6H20(Z) ——> 2B(OH)3(aq) + 6H2(g)
(ii) यह ऑक्सीजन में जलकर भारी मात्रा में गर्मी पैदा करता है
B2H6 + 302 —–> B203 + 3H20
(iii) लुईस आधार के साथ प्रतिक्रिया:
Lewis ठिकानों के साथ इलाज पर Diborane दरार बनाने के लिए दरारें से गुजरता है जो तब लुईस ठिकानों के साथ प्रतिक्रिया करता है कि व्यसनों का निर्माण होता है।
B2H6 + 2NMe3 ——-> 2BH3. NMe3
B2H6 + 2CO ———> 2BH3 .CO
• Group 14 Elements in hindi: कार्बन परिवार समूह 14 में कार्बन (C), सिलिकॉन (Si), जर्मेनियम (Ge), टिन (Sn) और सीसा (Pb) शामिल हैं।
कार्बन परिवार का सामान्य इलेक्ट्रॉनिक विन्यास ns2np1 है।
Carbon: कार्बन पृथ्वी की पपड़ी में भार से सत्रहवाँ सबसे प्रचुर तत्व है।
(i) यह कोयला, ग्रेफाइट और हीरे के रूप में उपलब्ध है। संयुक्त अवस्था में यह हवा में धातु कार्बोनेट, हाइड्रोकार्बन और कार्बन डाइऑक्साइड गैस (0.03%) में मौजूद है।
(ii) स्वाभाविक रूप से होने वाली कार्बन में दो स्थिर आयोसोटोप्स 12C और 13C और तीसरा आइसोटोप 14C होता है। 14C एक रेडियोधर्मी समस्थानिक है जिसका जीवनकाल 5770 वर्ष है और इसका उपयोग रेडियोकार्बन डेटिंग के लिए किया जाता है।
covalent radius :- सहसंयोजक त्रिज्या सी से सी तक बढ़ने की उम्मीद है। Si से Pb तक छोटी वृद्धि पाई जाती है।
Reason: प्रत्येक सफल तत्व में एक नई ऊर्जा के खोल के कारण। सी से पीबी तक सहसंयोजक रेडी में वृद्धि, हस्तक्षेप करने वाले डी- और एफ ऑर्बिटल्स द्वारा वैलेंस इलेक्ट्रॉनों के अप्रभावी परिरक्षण के कारण छोटा है।
Ionization Enthalpy: समूह 14 तत्वों की पहली आयनीकरण थैलेपीज़, संबंधित समूह 13 तत्वों की तुलना में अधिक है।
कारण: क्योंकि प्रभावी परमाणु प्रभार बढ़ता है और परमाणुओं का आकार छोटा हो जाता है। कार्बन से टिन तक समूह को नीचे ले जाने पर पहले आयनीकरण थैलीपी कम हो जाती है।
यह कमी कार्बन से सिलिकॉन तक बहुत तेज है, जबकि टिन की तुलना में सीसा के पहले आयनीकरण में थोड़ी वृद्धि हुई है।
Electronegativity For group 14 elements in chemistry: समूह 14 तत्व समूह 13 तत्वों की तुलना में आकार में छोटे होते हैं, इसलिए यह समूह समूह 13 की तुलना में थोड़ा अधिक विद्युतीय है। Si से Pb तक यह लगभग समान है। Sn से Pb तक के आयनीकरण में थैलेपी की छोटी वृद्धि, अतिरिक्त 4f- और 5d-इलेक्ट्रॉनों की उपस्थिति के कारण बढ़े हुए परमाणु चार्ज के प्रभाव से परिरक्षण प्रभाव के कारण होती है।
Physical properties for group 14 elements:
(i) समूह 14 के सभी तत्व ठोस हैं। वे समूह 13 की तुलना में कम धात्विक हैं।
(ii) एम.पी. और समूह 14 तत्वों के क्वथनांक सामान्यतः उच्च होते हैं।
Chemical properties:
कार्बन और सिलिकॉन ज्यादातर +4 ऑक्सीकरण अवस्था दिखाते हैं। जर्मेनियम +4 राज्य में स्थिर यौगिक बनाता है और +2 राज्य में केवल कुछ यौगिक हैं।
टिन ऑक्सीकरण अवस्थाओं में यौगिक बनाता है। +2 राज्य में लीड फॉर्म यौगिक स्थिर हैं और +4 राज्य में मजबूत ऑक्सीकरण एजेंट हैं।
• Anomalous Behaviour of Carbon
कार्बन, अपने परिवार के बाकी सदस्य से अलग है। विसंगतिपूर्ण व्यवहार का मुख्य कारण है:(i) असाधारण रूप से छोटे परमाणु और आयनिक आकार
(ii) उच्च आयनीकरण आंत्रशोथ
(iii) वैलेंस शेल में डी-ऑर्बिटल्स की अनुपस्थिति।
(iv) उच्चतर इलेक्ट्रॉनगति।
इसे इस प्रकार समझाया जा सकता है:
=> चूंकि कार्बन में केवल एस और पी-ऑर्बिटल्स हैं, इसलिए यह केवल चार जोड़े इलेक्ट्रॉनों को समायोजित कर सकता है; अन्य सदस्य डी-ऑर्बिटल्स की उपस्थिति के कारण अपने सहसंयोजन का विस्तार कर सकते हैं।
=> कार्बन छोटे आकार और उच्च विद्युतीयता वाले स्वयं और अन्य परमाणुओं के साथ Pπ-Pπ कई बांड बना सकता है।

Behaviour of Carbon
लीड कैटेनशन नहीं दिखाती है।
• Allotropes of Carbon in class 11 chemistry chapter 11 notes
एक तत्व की संपत्ति दो या दो से अधिक रूपों में मौजूद होती है जिसमें विभिन्न भौतिक गुण होते हैं लेकिन समान रासायनिक गुणों को एलोट्रॉपी कहा जाता है और विभिन्न रूपों को एलोट्रोप कहा जाता है। कार्बन दो एलोट्रोपिक रूपों में मौजूद है:(i) क्रिस्टलीय (ii) अनाकार
कार्बन का क्रिस्टलीय रूप: हीरा, ग्रेफाइट, फुलरीन डायमंड्स: हीरे में प्रत्येक कार्बन परमाणु sp3 संकरण से गुजरता है। प्रत्येक कार्बन tetrahedrally चार अन्य कार्बन परमाणुओं से जुड़ा हुआ है। सी-सी बांड की लंबाई 154 पीएम है।
Properties:
(i) यह पृथ्वी का सबसे कठोर पदार्थ है।
(ii) इसका उपयोग डाई बनाने और टंगस्टन फिलामेंट के निर्माण में कठोर उपकरणों को तेज करने के लिए एक अपघर्षक के रूप में किया जाता है।
graphite : ग्रेफाइट में, कार्बन sp2- संकरणित होता है। ग्रेफाइट में एक दो-आयामी शीट होती है जैसे संरचना जिसमें कई षट्कोणीय छल्ले एक साथ जुड़े होते हैं। वैन वैन वाल्स बलों द्वारा परतें हैं और दो परतों के बीच की दूरी 340 बजे है।
Properties of Graphite / chemical properties of diamond:
(i) ग्रेफाइट शीट के साथ बिजली का संचालन करता है।(ii) यह बहुत मुलायम और फिसलन वाला होता है।
(iii) उच्च तापमान पर चलने वाली मशीनों में ड्राई लुब्रिकेंट के रूप में उपयोग किया जाता है, जहाँ तेल को लुब्रिकेंट के रूप में इस्तेमाल नहीं किया जा सकता है।
Fullerenes: फुलरने को सामूहिक रूप से तीन वैज्ञानिकों ई। स्माल्ले, आर.एफ. कर्ल और एच। डब्ल्यू। क्रतो।
Preparation For Fullerenes : -
फुलरीन को हीलियम या आर्गन जैसे अक्रिय गैस की उपस्थिति में एक इलेक्ट्रिक आर्क में ग्रेफाइट के गर्म करके तैयार किया जाता है।Vapourised Cn छोटे अणुओं के संघनन से बनने वाली कालिख सामग्री में मुख्य रूप से C70 की छोटी मात्रा होती है और 350 या उससे अधिक कार्बन परमाणुओं की समान संख्या वाले अन्य फुलरीन के निशान होते हैं।
फुलरीन अणु की तरह पिंजरे में हैं। C60 अणु का आकार सॉकर बॉल की तरह होता है और इसे बकमिनस्टरफुलरलेनेस कहा जाता है। यह सबसे स्थिर है।
इसमें 20 छह-सदस्यीय छल्ले और 12 पाँच-सदस्यीय छल्ले शामिल हैं।
छह-सदस्यीय रिंगों को अन्य छह-सदस्यीय रिंगों और पांच-सदस्यीय रिंगों के लिए फ्यूज किया जाता है, लेकिन पांच-सदस्यीय रिंग्स केवल छह-सदस्यीय रिंगों से जुड़े होते हैं।
सभी कार्बन परमाणु समान हैं और वे sp2-Kybridization से गुजरते हैं
Properties For Fullerenes in class 11 chemistry chapter 11 notes
(i) फुलरीन को सहसंयोजक होने के कारण कार्बनिक सॉल्वैंट्स में घुलनशील होते हैं।(ii) यह प्लैटिनम कॉम्प्लेक्स भी बनाता है।
कार्बन कोक के अनाकार अलॉट्रोपिक रूप: यह एक ग्रे ब्लैक कठोर ठोस है और विनाशकारी विकृति द्वारा प्राप्त किया जाता है।
Wood charcoal: यह हवा की सीमित आपूर्ति में लकड़ी के मजबूत हीटिंग द्वारा प्राप्त किया जाता है।
Animal charcoal: यह हड्डियों के विनाशकारी आसवन द्वारा प्राप्त किया जाता है।
P block notes class 11 and Uses of carbon
(i) ग्रेफाइट फाइबर का उपयोग टेनिस और बैडमिंटन रैकेट, मछली पकड़ने की छड़ जैसे बेहतर खेल के सामान बनाने के लिए किया जाता है।(ii) बैटरी और औद्योगिक इलेक्ट्रोलिसिस के लिए इलेक्ट्रोड बनाने के लिए अच्छे कंडक्टर ग्रेफाइट का उपयोग किया जाता है।
(iii) अत्यधिक छिद्रपूर्ण होने के नाते, सक्रिय चारकोल का उपयोग गैस मास्क में जहरीली गैसों को अवशोषित करने के लिए किया जाता है। इसका उपयोग चीनी को डीकोलाइज करने के लिए किया जाता है।
(iv) कार्बन ब्लैक का उपयोग काली स्याही में काले वर्णक के रूप में और ऑटोमोबाइल टायरों में भराव के रूप में किया जाता है।
(v) कोक का उपयोग धातु विज्ञान में एजेंट को कम करने के रूप में किया जाता है।
(vi) हीरा एक कीमती पत्थर है।
• Some Important Compounds of Carbon and Silicon
- carbon monoxide preparation
तैयारी: इसे ऑक्सीजन की सीमित आपूर्ति में सी के प्रत्यक्ष ऑक्सीकरण द्वारा तैयार किया जाता है।- Properties For carbon monoxide
(i) कार्बन मोनोऑक्साइड एक रंगहीन और गंधहीन गैस है।(ii) यह पानी में लगभग अघुलनशील है।
(iii) यह शक्तिशाली कम करने वाला एजेंट है और क्षार और क्षारीय पृथ्वी धातु आक्साइड को छोड़कर लगभग सभी धातु आक्साइड को कम करता है।
(iv) CO अणु में कार्बन और ऑक्सीजन के बीच एक s (सिग्मा) और दो In बंध होते हैं।
: C = O:
(v) यह प्रकृति में अत्यधिक छिद्रपूर्ण है। यह हीमोग्लोबिन के साथ एक जटिल बनाता है जो ऑक्सीजन-हीमोग्लोबिन परिसर की तुलना में लगभग 300 गुना अधिक स्थिर होता है। यह लाल रक्त कणिकाओं में हीमोग्लोबिन को शरीर के चारों ओर ऑक्सीजन ले जाने से रोकता है, जिससे अंत में घुटन पैदा हो जाती है।
carbon dioxide : -
carbon dioxide preparation: यह कार्बन और कार्बन युक्त ईंधन के पूर्ण दहन द्वारा तैयार किया जाता है |
| carbon dioxide |
Properties for carbon dioxide
(i) यह एक रंगहीन और गंधहीन गैस है।(ii) यह पानी में थोड़ा घुलनशील है। जब C02 पानी में घुल जाता है तो केवल कुछ अणु कार्बोनिक एसिड बनाने के लिए पानी के साथ प्रतिक्रिया करते हैं।
(iii) यह सीओ की तरह जहरीला नहीं है।
लेकिन जीवाश्म ईंधन के दहन में वृद्धि और सीमेंट निर्माण के लिए चूना पत्थर के अपघटन के कारण एटमॉस्फियर में C02 की वृद्धि ग्रीन हाउस प्रभाव का एक मुख्य कारण है।
Silicon dioxide (Si02)
सिलिकॉन डाइऑक्साइड, जिसे आमतौर पर सिलिका के रूप में जाना जाता है, विभिन्न क्रिस्टलोग्राफिक रूपों में होता है।उदाहरण के लिए, क्वार्ट्ज, क्रिस्टोबलाइट और थर्माइट सिलिका के कुछ क्रिस्टलीय रूप हैं।
Structure For Silicon dioxide:
प्रत्येक सिलिकॉन परमाणु सहसंयोजी रूप से चार ऑक्सीजन परमाणुओं के लिए एक चतुर्भुज तरीके से बंधुआ है।
प्रत्येक ऑक्सीजन परमाणु बारी-बारी से दूसरे सिलिकॉन परमाणुओं से बंधे हुए हैं जैसा कि नीचे दिखाया गया है:
Properties for silicon dioxide for class 11 chemistry chapter 11 notes:
(ii) ऊंचे तापमान पर यह हैलोजन, डायहाइड्रोजेन और अधिकांश एसिड और धातुओं के साथ प्रतिक्रिया नहीं करता है। लेकिन यह HF और NaOH के साथ प्रतिक्रिया करता है।
Si02 + 2NaOH —–> Na2Si03 + H2O
Si02+ 4HF ——–> SiF4+ 2H20
Uses For Si02:
(ii) सिलिका जेल का उपयोग क्रोमैटोग्राफी में adsorbent के रूप में किया जाता है।
(iii) सिलिका, कैफेलगुर का एक अनाकार रूप निस्पंदन संयंत्रों में उपयोग किया जाता है।
• पी-ब्लॉक तत्व: इसमें धातुएँ, अधातुएँ और अधातुएँ हैं।
• सामान्य विन्यास: ns2np1-6
- बोरॉन एक विशिष्ट गैर-धातु है और अन्य सदस्य धातु हैं।
- बोरान हलाइड्स को लुईस एसिड की तरह व्यवहार करने के लिए माना जाता है।
- बोरिक एसिड एक लुईस एसिड है।
- बोरेक्स एक सफेद क्रिस्टलीय सोलाइड सूत्र है Na2 [B4O5 (OH) 4]। 8 एच 20
- एल्युमिनियम +3 ऑक्सीकरण अवस्था को प्रदर्शित करता है।
 |
| Properties for silicon dioxide: |
- अलॉट्रॉपी: कार्बन के महत्वपूर्ण अलॉट्रोप हीरे, ग्रेफाइट और फुलरीन हैं।
- कार्बन परिवार के सदस्य +4 और +2 ऑक्सीकरण अवस्था का प्रदर्शन करते हैं। भारी तत्वों के बीच +2 ऑक्सीकरण स्थिति दिखाने की प्रवृत्ति बढ़ जाती है।
- +2 राज्य में लीड स्थिर है जबकि +4 ऑक्सीकरण राज्य में यह एक मजबूत ऑक्सीकरण एजेंट है।
- कार्बन मोनोऑक्साइड तटस्थ है जबकि C02 प्रकृति में अम्लीय है।
- कार्बन मोनोऑक्साइड, C के इलेक्ट्रॉनों का अकेला जोड़ा है, जो धातु के कार्बोनिल होते हैं।
- कार्बन मोनोऑक्साइड एक हीमोग्लोबिन परिसर बनाता है जो इसकी उच्च स्थिरता के कारण घातक जहरीला होता है।
- जिओलाइट्स जटिल एल्यूमीनियम सिलिकेट्स हैं।














No comments:
Post a Comment