Structure of Atom Class 11 Notes Chemistry Chapter 2
Structure of Atom class 11 chemistry chapter 2 notes
• Discovery of Electron—Discharge Tube Experiment
1879 में, विलियम क्रुक्स ने कम दबाव में गैसों के माध्यम से बिजली के चालन का अध्ययन किया। उन्होंने एक डिस्चार्ज ट्यूब में प्रयोग किया, जो एक बेलनाकार कठोर ग्लास ट्यूब है जिसकी लंबाई लगभग 60 सेमी है।
 |
| cathode ray discharge tube |
गैसों के माध्यम से विद्युत निर्वहन केवल बहुत कम दबाव और बहुत अधिक वोल्टेज पर मनाया जा सकता है।
विभिन्न गैसों के दबाव को निकासी द्वारा समायोजित किया जा सकता है। जब इलेक्ट्रोड में पर्याप्त रूप से उच्च वोल्टेज लागू किया जाता है, तो नकारात्मक इलेक्ट्रोड (कैथोड) से सकारात्मक इलेक्ट्रोड (एनोड) तक ट्यूब में बढ़ने वाले कणों की एक धारा के माध्यम से प्रवाह शुरू होता है। इन्हें कैथोड किरणें या कैथोड किरण कण कहा जाता था।
• Properties of Cathode Rays in Hindi
(i) कैथोड किरणें सीधी रेखा में यात्रा करती हैं।
(ii) कैथोड किरणें कैथोड से शुरू होकर एनोड की ओर बढ़ती हैं।
(iii) ये किरणें स्वयं दिखाई नहीं देती हैं, लेकिन उनके व्यवहार को कुछ प्रकार की सामग्रियों (फ्लोरोसेंट या फॉस्फोरसेंट) की मदद से देखा जा सकता है, जो उनके हिट होने पर चमकते हैं।
(iv) कैथोड किरणें नकारात्मक चार्ज कणों से मिलकर बनती हैं। जब विद्युत क्षेत्र को कैथोड किरणों पर धातु की प्लेटों की एक जोड़ी की मदद से लगाया जाता है, तो ये धनात्मक प्लेट की ओर विक्षेपित पाए जाते हैं जो ऋणात्मक आवेश की उपस्थिति का संकेत देते हैं।
(v) कैथोड किरणों की विशेषताएँ कैथोड किरणों में मौजूद इलेक्ट्रोड की सामग्री और गैस की प्रकृति पर निर्भर नहीं करती हैं।
• Determination of Charge/Mass (elm) Ratio for Electrons
जे. जे. थॉमसन पहली बार प्रायोगिक तौर पर निर्धारित आवेश / द्रव्यमान अनुपात को इलेक्ट्रॉनों के लिए एल्म अनुपात कहते हैं। इसके लिए, उन्होंने विद्युत और चुंबकीय क्षेत्रों को प्रभावित करने के लिए कैथोड किरणों के रूप में डिस्चार्ज ट्यूब में जारी इलेक्ट्रॉनों के बीम को देखा।
ये एक दूसरे के साथ-साथ इलेक्ट्रॉनों द्वारा अनुसरण किए जाने वाले मार्ग पर लंबवत कार्य कर रहे थे।
थॉमसन के अनुसार, विद्युत और चुंबकीय क्षेत्र की उपस्थिति में उनके मार्ग से कणों के विचलन की मात्रा निम्नलिखित कारकों पर निर्भर करती है:
(i) कण पर आवेश का परिमाण अधिक है, विद्युत या चुंबकीय क्षेत्र के साथ अधिक से अधिक संपर्क है और इस प्रकार अधिक से अधिक विक्षेपण है।
(ii) कण का द्रव्यमान - कण को हल्का करता है, विक्षेपण अधिक होता है।
(iii) अपने मूल पथ से इलेक्ट्रॉनों का विक्षेपण इलेक्ट्रोड के पार या चुंबकीय क्षेत्र की शक्ति में वृद्धि के साथ बढ़ता है।
विद्युत क्षेत्र की ताकत या चुंबकीय क्षेत्र की ताकत पर इलेक्ट्रॉनों द्वारा देखे गए विक्षेपण की मात्रा पर सटीक माप करके, थॉमसन मूल्य का निर्धारण करने में सक्षम था
e / me = 1.758820 x 1011 C kg-1 जहाँ मी = इलेक्ट्रॉन का द्रव्यमान किलो में
e = युग्मन में इलेक्ट्रॉन पर आवेश का परिमाण (C)।
• Charge on the Electron
आर.ए. मिलिकन ने इलेक्ट्रॉनों पर आवेश निर्धारित करने के लिए तेल छोड़ने के प्रयोग के रूप में जाना जाने वाला एक तरीका तैयार किया।
 |
| charge on the electron |
• Discovery of Proton—Anode Rays For class 11 chemistry chapter 2 notes in Hindi
1886 में, गोल्डस्टीन ने छिद्रित कैथोड का उपयोग करके डिस्चार्ज ट्यूब को संशोधित किया। दबाव को कम करने पर, उसने एक नए प्रकार की चमकदार किरणों को देखा जो कैथोड के छिद्रों या छिद्रों से गुजरती थी और कैथोड किरणों के विपरीत एक दिशा में चलती थी।
इन किरणों को सकारात्मक किरणों या एनोड किरणों या कैनाल किरणों के रूप में नामित किया गया था। एनोड किरणों को एनोड से नहीं, बल्कि एनोड और कैथोड के बीच के स्थान से उत्सर्जित किया जाता है।
• Properties of Anode Rays
(i) एनोड किरणों को बनाने वाले कणों पर धनात्मक आवेश (e) का मान डिस्चार्ज ट्यूब में गैस की प्रकृति पर निर्भर करता है।
(ii) कणों के द्रव्यमान अनुपात का चार्ज उस गैस पर निर्भर पाया जाता है जिससे ये उत्पन्न होते हैं।
(iii) धनात्मक आवेशित कणों में से कुछ विद्युत आवेश की मूलभूत इकाई का एक भाग होता है।
(iv) चुंबकीय या विद्युत क्षेत्र में इन कणों का व्यवहार इलेक्ट्रॉन या कैथोड किरणों के लिए देखे गए विपरीत होता है।
• Proton
सबसे छोटा और सबसे हल्का धनात्मक आयन हाइड्रोजन से प्राप्त किया गया था और इसे प्रोटॉन कहा जाता था। प्रोटॉन का द्रव्यमान = 1.676 x 10-27 किग्रा
एक प्रोटॉन पर चार्ज = (+) 1.602 x 10-19 सी
• Neutron
यह एक तटस्थ कण है। इसकी खोज चाडविक (1932) ने की थी।
तेजी से बढ़ने वाले कणों के साथ बेरिलियम की पतली चादरों की बमबारी से उन्होंने देखा कि • अत्यधिक मर्मज्ञ किरणों में तटस्थ कण होते हैं जिन्हें न्यूट्रॉन कहा जाता था।
• Thomson Model of Atom in Hindi
 |
| Thomson Model of Atom |
(i) जे। जे। थॉमसन ने प्रस्तावित किया कि एक परमाणु को प्रोटॉन के कारण सकारात्मक आवेश वाले 1CT8 सेमी के अनुमानित क्षेत्र के रूप में माना जा सकता है और जिसमें नकारात्मक रूप से आवेशित इलेक्ट्रॉन एम्बेडेड होते हैं।
(ii) इस मॉडल में परमाणु को धनात्मक या केक के सकारात्मक आवेश के रूप में कल्पना की जाती है, जिसमें इलेक्ट्रान होते हैं।
(iii) परमाणु का द्रव्यमान इस मॉडल के अनुसार परमाणु में समान रूप से फैला हुआ माना जाता है।
Atom's Thomson model flawed
यह मॉडल परमाणु की समग्र तटस्थता की व्याख्या करने में सक्षम था, यह संतोषजनक रूप से नहीं कर सका, 1911 में रदरफोर्ड द्वारा किए गए प्रकीर्णन प्रयोगों के परिणामों की व्याख्या करें।
• Rutherford’s a-particle Scattering Experiment in Hindi
1911 में रदरफोर्ड ने कुछ प्रकीर्णन प्रयोग किए, जिसमें उन्होंने सोने, चांदी, प्लैटिनम या तांबे जैसी धातुओं के पतले जीवाश्मों पर तेजी से बढ़ते कणों की किरण के साथ बमबारी की। पतली सोने की पन्नी के चारों ओर एक परिपत्र फ्लोरोसेंट जस्ता सल्फाइड स्क्रीन थी।
जब भी कोई कण स्क्रीन पर टकराता है, तो प्रकाश की एक छोटी सी चमक उस बिंदु पर उत्पन्न होती है।
इन प्रयोगों से, उन्होंने निम्नलिखित अवलोकन किए:
 |
| Rutherford’s a-particle Scattering Experiment |
(i) अधिकांश ए-कण बिना किसी विक्षेपन के गुजर रहे पन्नी से होकर गुजरे,
(ii) कुछ कण छोटे कोणों के माध्यम से विक्षेपण करते हैं।
(iii) बहुत कम मात्र लगभग 180 ° के कोण से, अर्थात् पीछे हट जाती हैं।
Conclude For rutherford alpha particle scattering experiment
(i) चूँकि अधिकांश इन-कण बिना किसी विक्षेप के फ़ॉइल से गुज़रे, इसलिए परमाणु के भीतर पर्याप्त खाली जगह होनी चाहिए।
(ii) कणों का एक छोटा सा अंश छोटे कोणों से विक्षेपित होता था। धनात्मक आवेश को बहुत कम आयतन में संकेन्द्रित करना पड़ता है जो कि कुछ धनात्मक आवेशित कणों को निरस्त और विक्षेपित करता है। परमाणु के इस बहुत छोटे हिस्से को नाभिक कहा जाता था।
(iii) परमाणु की कुल मात्रा की तुलना में नाभिक का आयतन बहुत कम होता है।
• Rutherford’s Nuclear Model of an Atom in Hindi:
(i) सकारात्मक चार्ज और परमाणु का अधिकांश द्रव्यमान एक अत्यंत छोटे क्षेत्र में घनीभूत रूप से केंद्रित था। परमाणु के इस बहुत छोटे भाग को रदरफोर्ड ने नाभिक कहा था।
(ii) नाभिक इलेक्ट्रॉनों से घिरा होता है जो परिक्रमा पथों में बहुत तेज गति के साथ नाभिक के चारों ओर घूमते हैं।
(iii) आकर्षण के इलेक्ट्रोस्टैटिक बलों द्वारा इलेक्ट्रॉनों और नाभिकों को एक साथ रखा जाता है।
• What is Atomic Number in Hindi
नाभिक में मौजूद प्रोटॉनों की संख्या परमाणु संख्या (z) के बराबर होती है। उदाहरण के लिए, हाइड्रोजन नाभिक में प्रोटॉन की संख्या 1 है,
सोडियम परमाणु में यह 11 है, इसलिए, उनकी परमाणु संख्या 1 और 11 है। विद्युत तटस्थता रखने के लिए, एक परमाणु में इलेक्ट्रॉनों की संख्या बराबर है।
प्रोटॉन की संख्या (परमाणु संख्या, z)। उदाहरण के लिए, हाइड्रोजन परमाणु और सोडियम परमाणु में इलेक्ट्रॉनों की संख्या क्रमशः 1 और 11 है।
परमाणु संख्या (z) = किसी परमाणु के नाभिक में प्रोटॉन की संख्या।
= एक तटस्थ परमाणु में इलेक्ट्रॉनों की संख्या।
• What is Mass Number in Hindi:
नाभिक में मौजूद प्रोटॉन और न्यूट्रॉन की संख्या को सामूहिक रूप से नाभिक के रूप में जाना जाता है। परमाणु की कुल संख्या को परमाणु की द्रव्यमान संख्या (ए) के रूप में कहा जाता है।
मास संख्या (A) = प्रोटॉन की संख्या (P) + न्यूट्रॉन की संख्या (N)।
•What is Isotopes in Hindi
समान परमाणु संख्या वाले परमाणु लेकिन विभिन्न परमाणु द्रव्यमान संख्याओं को आइसोटोप के रूप में जाना जाता है।
हाइड्रोजन के समस्थानिक:
 |
| isotopes |
 |
| isotopes of chlorine |
Characteristics of Isotopes in Hindi
(i) चूँकि किसी तत्व के समस्थानिकों में एक ही परमाणु संख्या होती है, लेकिन अलग-अलग द्रव्यमान संख्या, समस्थानिकों के नाभिक में समान संख्या में प्रोटॉन होते हैं, लेकिन विभिन्न संख्या में न्यूट्रॉन होते हैं।
(ii) चूंकि, समस्थानिक अपने परमाणु द्रव्यमान में भिन्न होते हैं, द्रव्यमान के आधार पर समस्थानिक के सभी गुण अलग-अलग होते हैं।
(iii) चूँकि, रासायनिक गुण मुख्य रूप से नाभिक में प्रोटॉन की संख्या और परमाणु में इलेक्ट्रॉनों की संख्या से निर्धारित होते हैं, एक तत्व के विभिन्न समस्थानिक समान रासायनिक गुणों को प्रदर्शित करते हैं। उदाहरण के लिए, जलने पर कार्बन के सभी समस्थानिक कार्बन डाइऑक्साइड देते हैं।
• Isobars in Hindi
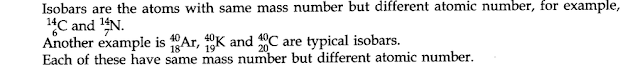 |
| Isobars |
• Drawbacks of Rutherford Model For class 11 chemistry chapter 2 notes
(i) जब कोई शरीर किसी कक्षा में घूम रहा होता है, तो यह त्वरण को प्राप्त करता है। इस प्रकार, कक्षा में नाभिक के चारों ओर घूमने वाला एक इलेक्ट्रॉन त्वरण के अंतर्गत होता है।
मैक्सवेल के विद्युत चुम्बकीय सिद्धांत के अनुसार, त्वरित कणों को विद्युत चुम्बकीय विकिरणों का उत्सर्जन करना चाहिए।
इसलिए, एक कक्षा में एक इलेक्ट्रॉन विकिरणों का उत्सर्जन करेगा, विकिरण द्वारा ली गई ऊर्जा इलेक्ट्रॉनिक गति से आती है। इसका रास्ता नाभिक के करीब हो जाएगा और अंततः भीतर नाभिक में सर्पिल होना चाहिए। 10-8 एस। लेकिन वास्तव में ऐसा नहीं होता है।
इस प्रकार, रदरफोर्ड का मॉडल परमाणु की स्थिरता की व्याख्या नहीं कर सकता है यदि इलेक्ट्रॉनों की गति को शास्त्रीय यांत्रिकी और विद्युत चुम्बकीय सिद्धांत के आधार पर वर्णित किया जाता है।
(ii) रदरफोर्ड का मॉडल नाभिक के चारों ओर इलेक्ट्रॉनों के वितरण और उनकी ऊर्जा के बारे में कोई विचार नहीं देता है।
• Developments Leading to the Bohr’s Model of Atom
बोहर के परमाणु के मॉडल के निर्माण में दो घटनाक्रमों की प्रमुख भूमिका थी। ये थे:
(i) विद्युत चुम्बकीय विकिरण का दोहरा चरित्र जिसका अर्थ है कि विकिरण में तरंग जैसे और कण जैसे गुण होते हैं।
(ii) परमाणु स्पेक्ट्रा के संबंध में प्रायोगिक परिणाम जो परमाणुओं में परिमाणित इलेक्ट्रॉनिक ऊर्जा स्तर मानकर ही समझाया जा सकता है।
• Nature of Electromagnetic Radiation class 11 chemistry chapter 2 notes in Hindi (Electromagnetic Wave Theory)
इस सिद्धांत को 1864 में जेम्स क्लार्क मैक्सवेल ने आगे रखा था। इस सिद्धांत के मुख्य बिंदु इस प्रकार हैं:
(i) ऊर्जा को किसी भी स्रोत (जैसे गर्म रॉड या एक बल्ब का फिलामेंट जिसके माध्यम से विद्युत प्रवाह पारित किया जाता है) से विकिरण के रूप में लगातार उत्सर्जित किया जाता है और इसे रेडिएंट ऊर्जा कहा जाता है।
(ii) विकिरण में विद्युत और चुंबकीय क्षेत्र होते हैं जो एक दूसरे के लिए लंबवत होते हैं और दोनों ही विकिरण के प्रसार की दिशा में लंबवत होते हैं।
(iii) विकिरण में तरंग वर्ण होते हैं और प्रकाश 3 x 108 मीटर / सेकंड के वेग के साथ यात्रा करते हैं।
(iv) इन तरंगों को प्रसार के लिए किसी भी भौतिक माध्यम की आवश्यकता नहीं होती है। उदाहरण के लिए, सूर्य से किरणें अंतरिक्ष के माध्यम से हम तक पहुंचती हैं जो एक गैर-भौतिक माध्यम है।
• Characteristics of a Wave in Hindi
तरंग दैर्ध्य: यह किसी भी दो लगातार क्रस्ट या गर्त के बीच की दूरी के रूप में परिभाषित किया गया है। यह X द्वारा दर्शाया गया है और इसकी S.I इकाई मीटर है।
फ्रीक्वेंसी: एक तरंग की आवृत्ति को एक सेकंड में एक बिंदु से गुजरने वाली तरंगों की संख्या के रूप में परिभाषित किया जाता है। यह v (nu) द्वारा दर्शाया गया है और हर्ट्ज (Hz) में व्यक्त किया गया है।
1 हर्ट्ज = 1 चक्र / सेकंड।
वेग: एक तरंग के वेग को एक सेकंड में तरंग द्वारा तय की गई रैखिक दूरी के रूप में परिभाषित किया जाता है।
इसे c से दर्शाया जाता है और इसे cm / sec या m / sec में व्यक्त किया जाता है।
आयाम: एक तरंग का आयाम शिखा की ऊंचाई या थ्रू की गहराई है। यह वी द्वारा दर्शाया गया है और लंबाई की इकाइयों में व्यक्त किया गया है।
वेव नंबर: इसे 1 मीटर लंबाई में मौजूद तरंगों की संख्या के रूप में परिभाषित किया गया है। जाहिर है यह तरंग दैर्ध्य के पारस्परिक के बराबर होगा। इसे बार v (नु बार के रूप में पढ़ें) द्वारा दर्शाया जाता है।
• Limitations of Electromagnetic Wave Theory in Hindi
विद्युत चुम्बकीय तरंग सिद्धांत प्रकाश के गुणों जैसे कि हस्तक्षेप, विवर्तन आदि की व्याख्या करने में सफल रहा; लेकिन यह निम्नलिखित की व्याख्या नहीं कर सका:
(i) ब्लैक बॉडी रेडिएशन की घटना।
(ii) फोटोइलेक्ट्रिक प्रभाव।
(iii) तापमान के कार्य के रूप में ठोस पदार्थों की ऊष्मा क्षमता का परिवर्तन।
(iv) हाइड्रोजन के संदर्भ में परमाणुओं की लाइन स्पेक्ट्रा।
• Black Body Radiation in Hindi
आदर्श शरीर, जो सभी आवृत्तियों को उत्सर्जित और अवशोषित करता है, उसे ब्लैक बॉडी कहा जाता है और ऐसे शरीर द्वारा उत्सर्जित विकिरण को ब्लैक बॉडी रेडिएशन कहा जाता है। एक काले शरीर से उत्सर्जित विकिरण का सटीक आवृत्ति वितरण केवल उसके तापमान पर निर्भर करता है।
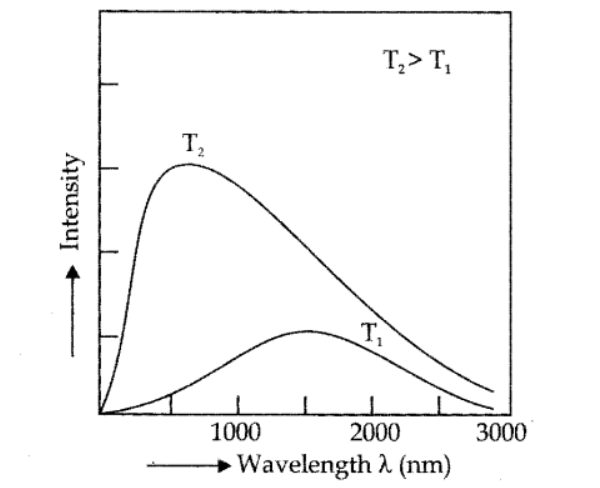 |
| blackbody spectrum |
• Planck’s Quantum Theory
1900 में body ब्लैक बॉडी रेडिएशन ’और फोटोइलेक्ट्रिक प्रभाव की घटना की व्याख्या करने के लिए, मैक्स प्लैंक ने, प्लैंक के क्वांटम सिद्धांत के नाम से एक सिद्धांत सामने रखा।
इस सिद्धांत को 1905 में आइंस्टीन द्वारा आगे बढ़ाया गया था। इस सिद्धांत के मुख्य बिंदु इस प्रकार थे:
(i) ऊर्जा के छोटे पैकेट के रूप में उत्सर्जित या अवशोषित होने वाली उज्ज्वल ऊर्जा। ऊर्जा के ऐसे प्रत्येक पैकेट को क्वांटम कहा जाता है।
(ii) प्रत्येक क्वांटम की ऊर्जा विकिरण की आवृत्ति के सीधे आनुपातिक होती है
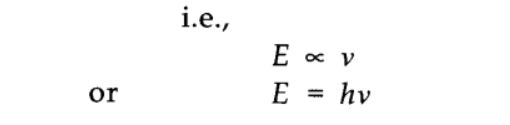 |
| Planck’s Quantum Theory |
जहाँ h एक आनुपातिकता स्थिरांक है, जिसे प्लांक का स्थिरांक कहा जाता है। इसका मूल्य 6.626 x 10-34 Jsec के बराबर है।
• Photoelectric Effect in Hindi class 11 chemistry chapter 2 notes
हर्ट्ज ने, 1887 में, पता लगाया कि जब कुछ आवृत्ति के प्रकाश का एक बीम कुछ धातुओं की सतह पर हमला करता है, तो इलेक्ट्रॉनों को धातु की सतह से उत्सर्जित या उत्सर्जित किया जाता है। घटना को फोटोइलेक्ट्रिक प्रभाव कहा जाता है।
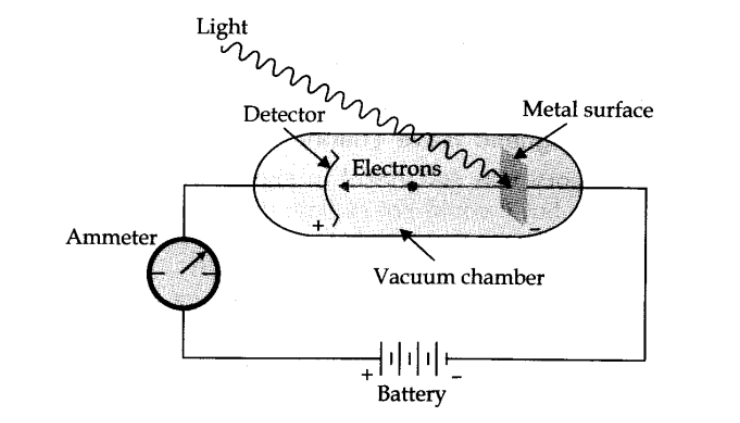 |
| Photoelectric Effect |
Observations in Photoelectric Effect in Hindi
(i) थ्रेशोल्ड फ्रीक्वेंसी (v0) नामक कुछ न्यूनतम आवृत्ति के प्रकाश के केवल फोटोन ही फोटोइलेक्ट्रिक प्रभाव पैदा कर सकते हैं। V0 का मान अलग-अलग धातुओं के लिए अलग-अलग होता है।
(ii) इलेक्ट्रॉनों की गतिज ऊर्जा जो उत्सर्जित होती है वह सीधे हड़ताली फोटॉनों की आवृत्ति के समानुपाती होती है और उनकी तीव्रता से काफी स्वतंत्र होती है।
(iii) धातु की सतह से प्रति सेकंड निकले इलेक्ट्रॉनों की संख्या हड़ताली फोटॉनों या विकिरणों की तीव्रता पर निर्भर करती है न कि उनकी आवृत्ति पर।
Explanation of Photoelectric Effect class 11 chemistry handwritten notes pdf
आइंस्टीन इन (1905) प्लैंक के क्वांटम सिद्धांत का उपयोग करते हुए फोटोइलेक्ट्रिक प्रभाव के विभिन्न बिंदुओं का विवरण देने में सक्षम था:
(i) Photoelectrons को केवल तभी निकाला जाता है जब घटना प्रकाश में एक निश्चित न्यूनतम आवृत्ति (दहलीज आवृत्ति v0) हो
(ii) यदि घटना प्रकाश (v) की आवृत्ति थ्रेशोल्ड आवृत्ति (v0) से अधिक है, तो अतिरिक्त ऊर्जा (hv - hv0) इलेक्ट्रॉन को गतिज ऊर्जा के रूप में प्रदान की जाती है।
के. ई. बेदखल इलेक्ट्रॉन की
 |
| Explanation of Photoelectric Effect |
उत्सर्जित इलेक्ट्रॉन की ऊर्जा।
(iii) प्रकाश की तीव्रता बढ़ाने पर, अधिक इलेक्ट्रॉनों को बाहर निकाल दिया जाता है लेकिन इलेक्ट्रॉनों की ऊर्जा में परिवर्तन नहीं किया जाता है।
• Dual Behaviour of Electromagnetic Radiation For chemistry notes for class 11
प्रकाश के व्यवहार के अध्ययन से, वैज्ञानिक इस निष्कर्ष पर पहुंचे कि प्रकाश और अन्य विद्युत चुम्बकीय विकिरणों में दोहरी प्रकृति होती है।
ये तरंग प्रकृति के साथ-साथ कण प्रकृति भी हैं। जब भी विकिरण पदार्थ के साथ परस्पर क्रिया करता है, यह कण को तरंग दैर्ध्य गुणों (हस्तक्षेप और विवर्तन) के विपरीत गुणों की तरह प्रदर्शित करता है जो इसे प्रचारित करते समय प्रदर्शित करता है।
इलेक्ट्रॉनों जैसे कुछ सूक्ष्म कण भी इस तरंग-कण द्वंद्व को प्रदर्शित करते हैं।
• Wave Spectrum
जब सफेद प्रकाश की किरण को प्रिज्म से गुजारा जाता है, तो छोटी तरंग दैर्ध्य वाली तरंग लंबी तरंग दैर्ध्य के साथ एक से अधिक झुक जाती है।
चूंकि साधारण सफेद रोशनी में दृश्यमान रेंज में सभी तरंग दैर्ध्य के साथ तरंगें होती हैं, इसलिए सफेद प्रकाश की सरणी वर्णक्रम नामक रंगीन बैंड की एक श्रृंखला में फैल जाती है।
लाल रंग का प्रकाश जिसमें सबसे लंबी तरंग दैर्ध्य होती है, सबसे कम विचलित होता है, जबकि वायलेट प्रकाश, जिसमें सबसे कम तरंगदैर्घ्य होता है, सबसे अधिक विचलित होता है।
Continuous Spectrum in Hindi
जब एक प्रकाश की किरण का प्रिज्म से गुजरते हुए विश्लेषण किया जाता है तो यह देखा जाता है कि यह वायलेट से लाल (इंद्रधनुष की तरह) रंगों के सात अलग-अलग चौड़े बैंडों में विभाजित हो जाती है।
ये रंग इतने निरंतर हैं कि उनमें से प्रत्येक अगले में विलीन हो जाता है। इसलिए, स्पेक्ट्रम को निरंतर स्पेक्ट्रम कहा जाता है।
Emission Spectra :-
उत्सर्जन स्पेक्ट्रा को देखा जाता है जब एक स्रोत से उत्सर्जित विकिरण एक प्रिज्म के माध्यम से पारित हो जाते हैं और फिर फोटोग्राफिक प्लेट पर प्राप्त होते हैं। विकिरणों को कई तरीकों से उत्सर्जित किया जा सकता है जैसे:
(i) सूरज से या चमकते बिजली के बल्ब से।
(ii) कम दबाव पर गैस के माध्यम से बिजली के निर्वहन से गुजरना।
(iii) किसी पदार्थ को उच्च तापमान पर गर्म करके।
Line Spectra
जब कुछ वाष्पशील पदार्थ के वाष्प को बन्सेन बर्नर की आंच पर गिरने दिया जाता है और तब स्पेक्ट्रोस्कोप की मदद से विश्लेषण किया जाता है।
फोटोग्राफिक प्लेट पर कुछ विशिष्ट रंगीन रेखाएँ दिखाई देती हैं जो विभिन्न पदार्थों के लिए भिन्न होती हैं।
उदाहरण के लिए, सोडियम या इसके लवण पीले प्रकाश का उत्सर्जन करते हैं जबकि पोटेशियम या इसके लवण बैंगनी प्रकाश देते हैं।
Absorption Spectra
जब किसी पदार्थ के वाष्पों के माध्यम से श्वेत प्रकाश को पार किया जाता है और प्रेषित प्रकाश को एक प्रिज्म पर प्रहार करने की अनुमति दी जाती है, तो अन्यथा निरंतर स्पेक्ट्रम में अंधेरे रेखाएं दिखाई देती हैं।
अंधेरे रेखाएं बताती हैं कि उनके अनुरूप विकिरण श्वेत प्रकाश से पदार्थ द्वारा अवशोषित किए गए थे। इस स्पेक्ट्रम को अवशोषण स्पेक्ट्रम कहा जाता है।
डार्क लाइनें ठीक उसी स्थिति में दिखाई देती हैं जहां उत्सर्जन स्पेक्ट्रा में लाइनें दिखाई देती हैं।
• Line Spectrum of Hydrogen
जब बिजली के डिस्चार्ज को कम दबाव में डिस्चार्ज ट्यूब में संलग्न हाइड्रोजन गैस के माध्यम से पारित किया जाता है और उत्सर्जित प्रकाश का स्पेक्ट्रोस्कोप द्वारा विश्लेषण किया जाता है,
तो स्पेक्ट्रम में बड़ी संख्या में लाइनें होती हैं जिन्हें अलग-अलग श्रृंखलाओं में वर्गीकृत किया जाता है। पूर्ण स्पेक्ट्रम को हाइड्रोजन स्पेक्ट्रम के रूप में जाना जाता है।
प्रायोगिक अवलोकनों के आधार पर, जोहान्स रिडबर्ग ने कहा कि हाइड्रोजन स्पेक्ट्रम की सभी श्रृंखलाओं को निम्नलिखित अभिव्यक्ति द्वारा वर्णित किया जा सकता है:
 |
| Line Spectrum of Hydrogen |
1890 में Rydberg, और हाइड्रोजन स्पेक्ट्रम की विभिन्न श्रृंखला में वर्णक्रमीय लाइनों की तरंग दैर्ध्य और लहर संख्या की गणना के लिए एक सरल सैद्धांतिक समीकरण दिया है।
समीकरण को Rydberg सूत्र (या समीकरण) के रूप में जाना जाता है।
यह संबंध केवल हाइड्रोजन परमाणु के लिए मान्य है। अन्य प्रजातियों के लिए,
जहाँ Z प्रजातियों की परमाणु संख्या है।
यहाँ आरएच = स्थिर, हाइड्रोजन और n1 के लिए Rydberg स्थिर कहा जाता है, n2 पूर्णांक हैं (n2> n1)
किसी विशेष श्रृंखला के लिए, n1 का मान स्थिर है जबकि n2 में परिवर्तन होता है। उदाहरण के लिए,
लाइमैन श्रृंखला के लिए, n1 = 1, n2 = 2, 3, 4, 5 ……… ..
बामर श्रृंखला के लिए, n1 = 2, n2 = 3, 4, 5, 6 ……… ..
पासचेन श्रृंखला के लिए, n1 = 3, n2 = 4, 5, 6, 7 ……… ..
ब्रैकेट श्रृंखला के लिए, n1 = 4, n2 = 5, 6, 7, 8 ……… ..
Pundund श्रृंखला के लिए, n1 = 5, n2 = 6, 7, 8, 9 ……… ..
इस प्रकार, उपरोक्त समीकरण में n1 और n2 के मूल्यों को प्रतिस्थापित करके, विभिन्न वर्णक्रमीय रेखाओं की तरंग दैर्ध्य और तरंग संख्या की गणना की जा सकती है। जब n1 = 2, ऊपर दी गई अभिव्यक्ति को बामर का सूत्र कहा जाता है।
• Bohr’s Model of Atom For class 11 chemistry chapter 2 notes in Hindi
1913 में नील्स बोह्र ने प्लैंक की क्वांटम थ्योरी के आधार पर परमाणु का एक नया मॉडल प्रस्तावित किया। इस मॉडल के मुख्य बिंदु इस प्रकार हैं:
(i) एक परमाणु में, इलेक्ट्रॉन कुछ निश्चित गोलाकार रास्तों में नाभिक के चारों ओर चक्कर लगाते हैं जिन्हें कक्षा कहा जाता है।
(ii) प्रत्येक कक्षा निश्चित ऊर्जा से जुड़ी होती है और इसलिए इन्हें ऊर्जा के रूप में जाना जाता है
स्तर या ऊर्जा के गोले। इन्हें 1, 2, 3, 4 ……… या के रूप में गिना जाता है। K, L, M, N ……… ..
(iii) केवल उन ऊर्जा कक्षाओं को इलेक्ट्रॉन के लिए अनुमति दी जाती है, जिसमें इलेक्ट्रॉन की कोणीय गति h / 2 of की एक पूरी संख्या कई होती है
इलेक्ट्रॉन का कोणीय संवेग (mvr) = nh / 2 = (n = 1, 2, 3, 4 etc)।
m = इलेक्ट्रॉन का द्रव्यमान।
v = परिक्रामी इलेक्ट्रॉन का स्पर्शरेखा वेग।
आर = कक्षा की त्रिज्या।
h = प्लैंक स्थिर।
n एक पूर्णांक है।
(iv) जब तक इलेक्ट्रॉन किसी विशेष कक्षा में मौजूद होता है, तब तक यह न तो ऊर्जा को अवशोषित करता है और न ही ऊर्जा खोता है और इसलिए, यह स्थिर रहता है।
(v) जब ऊर्जा को एक इलेक्ट्रॉन को आपूर्ति की जाती है, तो यह केवल निर्धारित मात्रा में ऊर्जा को अवशोषित करती है और क्वांटा से उच्च ऊर्जा अवस्था तक उछल जाती है,
जिसे उत्तेजित अवस्था के रूप में जाना जाता है। उत्तेजित अवस्था अस्थिर होती है, इलेक्ट्रॉन वापस निम्न ऊर्जा अवस्था में जा सकता है और ऐसा करने पर, वह ऊर्जा की समान मात्रा का उत्सर्जन करता है। (EE = E2 - E1)।
• Achievements of Bohr’s Theory
1. बोहर के सिद्धांत ने एक परमाणु की स्थिरता को समझाया है।
2. बोहर के सिद्धांत ने हाइड्रोजन परमाणु और एक इलेक्ट्रॉन प्रजातियों में इलेक्ट्रॉन की ऊर्जा की गणना करने में मदद की है। एनटी कक्षा में ऊर्जा के लिए गणितीय अभिव्यक्ति है,
 |
| Achievements of Bohr’s Theory |
• Limitations of Bohr’s Model
(i) सिद्धांत परमाणुओं के परमाणु स्पेक्ट्रा की व्याख्या नहीं कर सकता है जिसमें एक से अधिक इलेक्ट्रॉन या मल्टीलेर्रॉन परमाणु होते हैं।
(ii) बोह्र्स 7 सिद्धांत वर्णक्रमीय रेखाओं की महीन संरचना की व्याख्या करने में विफल रहा।
(iii) बोहर का सिद्धांत ज़ीमान प्रभाव और स्टार्क प्रभाव की कोई संतोषजनक व्याख्या नहीं दे सका।
(iv) बोहर का सिद्धांत रासायनिक बांडों द्वारा गठित अणु बनाने के लिए परमाणुओं की क्षमता की व्याख्या करने में विफल रहा।
(v) यह हाइजेनबर्ग के अनिश्चितता सिद्धांत के अनुसार नहीं था।
• Dual Behaviour of Matter (de Broglie Equation)
डी ब्रोगली ने 1924 में प्रस्तावित किया कि वह पदार्थ, विकिरण की तरह, दोहरे व्यवहार को भी प्रदर्शित करना चाहिए, अर्थात, जैसे कण और गुण जैसे तरंग।
इसका मतलब है कि फोटॉन की तरह, इलेक्ट्रॉनों में भी गति के साथ-साथ तरंगदैर्ध्य भी होता है।
इस सादृश्य से, डी ब्रोगली ने एक भौतिक कण के तरंग दैर्ध्य (λ) और गति (पी) के बीच निम्नलिखित संबंध दिए।
 |
| Dual Behaviour of Matter (de Broglie Equation) |
• Heisenberg’s Uncertainty Principle in Hindi
यह बताता है कि, "एक इलेक्ट्रॉन की सटीक स्थिति और सटीक गति (या वेग) एक साथ निर्धारित करना असंभव है"।
 |
| Heisenberg’s Uncertainty Principle |
• Significance of Uncertainty Principle
(i) यह इलेक्ट्रॉनों और अन्य समान कणों के निश्चित पथ या प्रक्षेपवक्र के अस्तित्व को नियंत्रित करता है।
(ii) हाइजेनबर्ग के अनिश्चितता सिद्धांत का प्रभाव केवल सूक्ष्म वस्तुओं के लिए महत्वपूर्ण है और स्थूल वस्तुओं के लिए नगण्य है।
• Reasons for the Failure of Bohr Model.
(i) बोहर मॉडल में इलेक्ट्रॉन के तरंग चरित्र को नहीं माना जाता है।
(ii) बोह्र मॉडल के अनुसार एक कक्षा एक स्पष्ट रूप से परिभाषित पथ है और इस पथ को पूरी तरह से केवल तभी परिभाषित किया जा सकता है जब इलेक्ट्रॉन की स्थिति और वेग दोनों एक ही समय में बिल्कुल ज्ञात हों। हाइजेनबर्ग के अनिश्चितता सिद्धांत के अनुसार यह संभव नहीं है।
•Quantum Mechanical Model of Atom
Quantum mechanics: क्वांटम यांत्रिकी एक सैद्धांतिक विज्ञान है जो सूक्ष्म वस्तुओं की गतियों के अध्ययन से संबंधित है जिसमें गुण जैसे तरंग और कण दोनों हैं।
Important Features of Quantum Mechanical Model of Atom
(i) परमाणु में इलेक्ट्रॉनों की ऊर्जा को परिमाणित किया जाता है, अर्थात, केवल कुछ मान हो सकते हैं।
(ii) परिमाणित इलेक्ट्रॉनिक ऊर्जा स्तर का अस्तित्व इलेक्ट्रॉनों के गुणों की तरह तरंग का प्रत्यक्ष परिणाम है।
(iii) एक परमाणु में इलेक्ट्रॉन की सटीक स्थिति और सटीक वेग दोनों एक साथ निर्धारित नहीं किए जा सकते हैं।
(iv) एक परमाणु कक्षीय की तरंग क्रिया omic है। एक परमाणु में कई ऑर्बिटल्स होते हैं। इलेक्ट्रॉन एक परमाणु कक्षीय पर कब्जा कर लेता है जिसमें निश्चित ऊर्जा होती है।
एक कक्षीय में दो से अधिक इलेक्ट्रॉन नहीं हो सकते। ऑर्बिटल्स ऊर्जा के बढ़ते क्रम में भरे हुए हैं।
एक परमाणु में इलेक्ट्रॉन के बारे में सभी जानकारी कक्षीय तरंग फ़ंक्शन electron में संग्रहीत होती है।
(v) एक परमाणु के भीतर एक बिंदु पर इलेक्ट्रॉन को खोजने की संभावना कक्षीय तरंग फ़ंक्शन के वर्ग के आनुपातिक है यानी; |φ2| उस बिंदु पर | इसे प्रायिकता घनत्व के रूप में जाना जाता है और यह हमेशा सकारात्मक होता है।
परमाणु के भीतर विभिन्न बिंदुओं पर φ2 के मान से, नाभिक के आसपास के क्षेत्र की भविष्यवाणी करना संभव है जहां इलेक्ट्रॉन सबसे अधिक पाया जाएगा।
• What is Quantum Numbers in Hindi
परमाणु ऑर्बिटल्स को उनकी संबंधित ऊर्जा और कोणीय गति प्रदान करके निर्दिष्ट किया जा सकता है जो कि परिमाणित हैं (अर्थात, उनके विशिष्ट मान हैं)।
परिमाणित मानों को क्वांटम संख्या के संदर्भ में व्यक्त किया जा सकता है। इनका उपयोग इलेक्ट्रॉन के बारे में पूरी जानकारी प्राप्त करने के लिए किया जाता है अर्थात् इसके स्थान, ऊर्जा, स्पिन आदि।
प्रिंसिपल क्वांटम नंबर (n)
यह सबसे महत्वपूर्ण क्वांटम संख्या है क्योंकि यह प्रिंसिपल एनर्जी लेवल या शेल को बताता है जिसमें इलेक्ट्रॉन होता है। इसे V अक्षर से दर्शाया गया है और इसमें शून्य, यानी, n = 1, 2, 3, 4 ……… .. आदि को छोड़कर कोई भी अभिन्न मूल्य हो सकता है।
नाभिक से शुरू होने वाले K,L,M,N,O,P… .. आदि अक्षरों द्वारा विभिन्न प्रमुख ऊर्जा के गोले भी नामित किए जाते हैं।
The principal quantum number gives us the following information:
(i) यह नाभिक से इलेक्ट्रॉन की औसत दूरी देता है।
(ii) यह हाइड्रोजन परमाणु और हाइड्रोजन जैसे कणों में इलेक्ट्रॉन की ऊर्जा को पूरी तरह से निर्धारित करता है।
(iii) किसी भी प्रिंसिपल शेल में मौजूद इलेक्ट्रॉनों की अधिकतम संख्या 2(n^2) द्वारा दी गई है जहां n प्रिंसिपल शेल की संख्या है।
Azimuthal या सहायक या कक्षीय कोणीय क्वांटम संख्या (एल)
यह पाया गया है कि तत्वों के स्पेक्ट्रा में न केवल मुख्य लाइनें हैं, बल्कि कई ठीक लाइनें भी मौजूद हैं।
यह संख्या स्पेक्ट्रम की महीन रेखाओं को समझाने में मदद करती है।
Azimuthal or Subsidiary or Orbital Angular Quantum Number (l)
(i) मुख्य खोल में मौजूद उप-संख्या की संख्या।
(ii) किसी भी उपधारा में मौजूद इलेक्ट्रॉन का कोणीय संवेग।
(इन) विभिन्न उपधाराओं की सापेक्ष ऊर्जाएँ।
(iv) एक ही प्रिंसिपल शेल के भीतर मौजूद विभिन्न उपधाराओं की आकृतियाँ।
इस क्वांटम संख्या को T अक्षर द्वारा निरूपित किया जाता है। n के दिए गए मान के लिए, इसका कोई मान 0 से n तक हो सकता है - 1. उदाहरण के लिए,
1 शेल (k), n = 1 के लिए, l का केवल एक मान हो सकता है यानी, l = 0 n = 2 के लिए, l का संभावित मान 0 और 1 हो सकता है।
एल के विभिन्न मूल्यों के अनुरूप सब्सक्रिप्शन निम्न प्रतीकों द्वारा दर्शाए गए हैं:
मान 0 0 1 2 3 4 5 …………… ..
उपधारा s p d f g h के लिए अंकन ……………… ..
चुंबकीय कक्षीय क्वांटम संख्या (एम या एम 1)
चुंबकीय कक्षीय क्वांटम संख्या एक उपधारा में मौजूद इलेक्ट्रॉनों के पसंदीदा झुकाव की संख्या निर्धारित करती है। चूंकि प्रत्येक अभिविन्यास एक कक्षीय से मेल खाता है, इसलिए, चुंबकीय कक्षीय क्वांटम संख्या किसी भी उपधारा में मौजूद कक्षा की संख्या निर्धारित करती है।
चुंबकीय क्वांटम संख्या को अक्षर m या ml द्वारा निरूपित किया जाता है और l के दिए गए मान के लिए, इसमें शून्य से लेकर l + से लेकर l तक के सभी मान हो सकते हैं।
इस प्रकार, l के ऊर्जा मान के लिए, m में 2l + 1 मान हैं।
उदाहरण के लिए,
L = 0 (s-subshell) के लिए, ml का केवल एक मान हो सकता है, अर्थात, m1 = 0।
इसका मतलब यह है कि s-subshell में अंतरिक्ष में केवल एक अभिविन्यास है।
दूसरे शब्दों में, s-subshell में केवल एक कक्षीय है जिसे s-orbital कहा जाता है।
स्पिन क्वांटम संख्या (एस या एमएस)
यह क्वांटम संख्या पदार्थों के चुंबकीय गुणों को समझाने में मदद करती है।
एक कताई इलेक्ट्रॉन एक निश्चित चुंबकीय क्षण के साथ एक माइक्रोमैग्नेट की तरह व्यवहार करता है।
यदि एक कक्षीय में दो इलेक्ट्रॉन होते हैं, तो दो चुंबकीय क्षण एक दूसरे का विरोध करते हैं और रद्द करते हैं।
• Shapes of s-orbitals
s-orbital s-subshell में मौजूद है। इस उपधारा के लिए, l = 0 और ml = 0. इस प्रकार, केवल एक अभिविन्यास के साथ एस-ऑर्बिटल में तीनों अक्षों के साथ एक समान इलेक्ट्रॉन घनत्व के साथ एक गोलाकार आकृति होती है।
Is इलेक्ट्रॉन की संभावना नाभिक के पास अधिकतम पाई जाती है और नाभिक से दूरी में वृद्धि के साथ घट जाती है।
2 एस इलेक्ट्रॉन में, नाभिक के पास संभावना भी अधिकतम होती है और शून्य संभावना तक घट जाती है।
2 एस इलेक्ट्रॉन के लिए गोलाकार खाली खोल को नोडल सतह या बस नोड कहा जाता है।
 |
| s orbital |
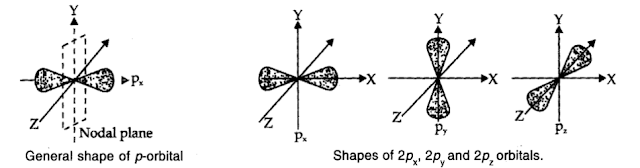
• Shapes of p-orbitals
पी-ऑर्बिटल्स पी-उप-उपाधि में मौजूद हैं जिसके लिए l = 1 और m1 में तीन संभावित अभिविन्यास हो सकते हैं - 1, 0, + 1।
इस प्रकार, पी-उपधारा में तीन ऑर्बिटल्स होते हैं, जिन्हें पीएक्स, पी और पीजी ऑर्बिटल्स के रूप में निर्दिष्ट किया जाता है, जिस अक्ष के साथ वे निर्देशित होते हैं।
पी-ऑर्बिटल का सामान्य आकार दो भागों से युक्त गूंगा-बेल है जिसे लोब्स के रूप में जाना जाता है।
इसके अलावा, वहाँ एक नाभिक के माध्यम से गुजर रहा है जिसके साथ इलेक्ट्रॉन घनत्व की खोज लगभग शून्य है।
यह नोडल विमान के रूप में जाना जाता है जैसा कि अंजीर में दिखाया गया है।
 |
| p block |
• Shapes of d-orbitals
d-orbitals d-subshell में मौजूद है जिसके लिए l = 2 और m [= -2, -1, 0, +1 और +2 है। इसका मतलब है कि पाँच अभिविन्यास हैं जो पांच अलग-अलग कक्षाओं में जाते हैं।
• Aufbau Principle in Hindi in Class 11 notes Chemistry Chapter 2:-
aufbau principle definition : - परमाणुओं की जमीनी अवस्था में, कक्षाएँ अपनी बढ़ती ऊर्जाओं के क्रम में भर जाती हैं।
दूसरे शब्दों में, इलेक्ट्रॉनों ने सबसे पहले उपलब्ध सबसे कम ऊर्जा कक्षीय पर कब्जा कर लिया और निम्न ऊर्जा कक्षा के भर जाने के बाद ही उच्च ऊर्जा कक्षा में प्रवेश करते हैं।
जिस क्रम में ऑर्बिटल्स की ऊर्जा बढ़ती है और इसलिए ऑर्बिटल्स भरे जाने का क्रम निम्नानुसार है:
है,
2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, id, 5p, 6s, if, 3d, 6p, 7s, 5f 6d, 7p
अंजीर में दी गई विधि का उपयोग करके आदेश को याद किया जा सकता है।
 |
| Aufbau Principle |
• Pauli Exclusion Principle
इस सिद्धांत के अनुसार, एक परमाणु में दो इलेक्ट्रॉनों में चार क्वांटम संख्याओं के समान सेट नहीं हो सकते हैं।
pauli exclusion principle definition: केवल दो इलेक्ट्रॉन एक ही कक्षीय में मौजूद हो सकते हैं और इन इलेक्ट्रॉनों में विपरीत स्पाइन होना चाहिए।
• Hund’s Rule of Maximum Multiplicity
इसमें कहा गया है: एक ही उपधारा (पी, डी या एफ) से संबंधित कक्षाओं में इलेक्ट्रॉनों की जोड़ी तब तक नहीं होती है जब तक कि उस उपधारा से संबंधित प्रत्येक कक्ष को प्रत्येक में एक इलेक्ट्रॉन नहीं मिल जाता है, अर्थात, यह एकल रूप से व्याप्त है।
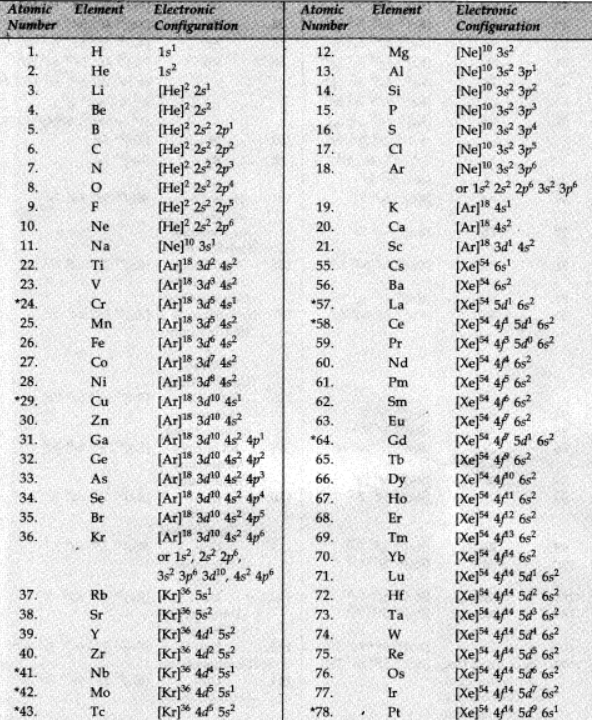
• Electronic Configuration of Atoms class 11 chemistry chapter 2 notes in Hindi
किसी परमाणु के ऑर्बिटल्स में इलेक्ट्रॉनों के वितरण को इसका इलेक्ट्रॉनिक कॉन्फ़िगरेशन कहा जाता है। विभिन्न परमाणुओं के इलेक्ट्रॉनिक विन्यास को दो तरीकों से दर्शाया जा सकता है।
उदाहरण के लिए:
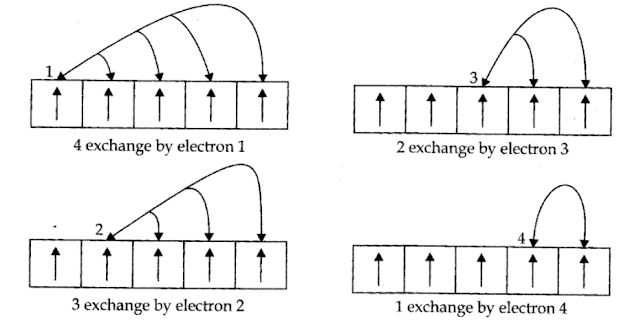
• Causes of Stability of Completely Filled and Half Filled Subshells
पूरी तरह से भरे और आधे भरे हुए उपसमूह निम्नलिखित कारणों से स्थिर हैं:
 |
| POSSIBLE EXCHANGE OF A d5 CONFRIGRATION |
1. इलेक्ट्रॉनों का सममित वितरण: पूरी तरह से भरे हुए या आधे भरे हुए उपखंडों में इलेक्ट्रॉनों का सममित वितरण होता है और इसलिए वे अधिक स्थिर होते हैं।
2. जब एक ही स्पिन वाले दो या दो से अधिक इलेक्ट्रॉन एक उपधारा की अध: पतन कक्षा में मौजूद होते हैं तो स्थिरीकरण प्रभाव उत्पन्न होता है। ये इलेक्ट्रॉन अपनी स्थिति का आदान-प्रदान करते हैं
और उनके विनिमय के कारण जारी ऊर्जा को विनिमय ऊर्जा कहा जाता है। एक्सचेंजों की संख्या अधिकतम है जब सबस्क्रिप्शन आधा भरा हुआ है या पूरी तरह से भरा हुआ है।
-एक परिणाम के रूप में विनिमय ऊर्जा अधिकतम है और इसलिए स्थिरता है।
 |
| TABLE |
 |
| class 11 chemistry chapter 2 notes |



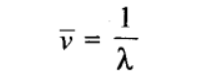






.png)
.png)




No comments:
Post a Comment