class 11 chemistry chapter 3 notes in Hindi - chemistry notes in Hindi
• Genesis of Periodic Classification Dobereiner’s Triads
1829 में, डोबरिनर ने तीन के समूहों में समान गुणों वाले कुछ तत्वों को इस तरह व्यवस्थित किया कि मध्य तत्व का परमाणु द्रव्यमान पहले और तीसरे तत्वों के औसत परमाणु द्रव्यमान के लगभग समान था। उनके द्वारा प्रस्तावित कुछ परीक्षणों को सूचीबद्ध किया गया है।
 |
| class 11 chemistry notes |
- Limitations of Dobereiner’s Trids
डोबेरिनर द्वारा दिए गए ट्रायड्स कुछ तत्वों को एक साथ समान विशेषताओं के साथ समूहीकृत करने में सहायक थे, लेकिन वह उस समय ज्ञात सभी तत्वों को ट्रायड्स में व्यवस्थित नहीं कर सके।
- Newlands’ Law of Octaves
जॉन न्यूलैंड्स ने अष्टकवर्ग के नियम को यह कहते हुए प्रस्तावित किया कि जब तत्वों को परमाणु द्रव्यमान बढ़ाने के क्रम में व्यवस्थित किया जाता है, प्रत्येक आठवें तत्व में पहले के समान गुण होते हैं। न्यूलैंड्स ने इसे सप्तक का नियम कहा क्योंकि इसी तरह का संबंध संगीत के नोटों में भी है।
इसका वर्णन इस प्रकार किया जा सकता है:
 |
| state newlands law of octaves |
- Limitations of Newlands’ Law of Octaves
(i) यह वर्गीकरण केवल कैल्शियम तत्व तक ही सफल था। उसके बाद, प्रत्येक आठवें तत्व के पास समान गुण नहीं थे, क्योंकि एक ही समूह में इसके ऊपर स्थित तत्व।
(ii) जब बाद के चरण में महान गैस तत्वों की खोज की गई, तो तालिका में उनके समावेश ने पूरी व्यवस्था को बिगाड़ दिया।
- Mendeleev’s Periodic Table
मेंडेलीव के आवधिक कानून: तत्वों के भौतिक और रासायनिक गुण एक आवधिक हैं
उनके परमाणु द्रव्यमान का कार्य।
मेंडेलीव ने उस समय ज्ञात तत्वों को व्यवस्थित किया जिससे परमाणु द्रव्यमान में वृद्धि हुई
और इस व्यवस्था को आवर्त सारणी कहा जाता था।
समान विशेषताओं वाले तत्व ऊर्ध्वाधर पंक्तियों में मौजूद थे जिन्हें समूह कहा जाता है। क्षैतिज
पंक्तियों को काल के रूप में जाना जाता था।
Description of Mendeleev’s Periodic Table class 11 chemistry notes in hindi
(i) आवर्त सारणी में, तत्वों को ऊर्ध्वाधर पंक्तियों में व्यवस्थित किया जाता है जिन्हें समूह और क्षैतिज पंक्तियों को पीरियड कहा जाता है।
(ii) I, II, III, IV, V, VI, VII, VIII और शून्य के रूप में रोमन संख्याओं द्वारा इंगित नौ समूह हैं। समूह VIII में नौ तत्व शामिल हैं जो तीन परीक्षणों में व्यवस्थित हैं। शून्य समूह में निष्क्रिय गैसों या महान गैसों से संबंधित तत्व होते हैं और मौजूद तत्वों में शून्य वैधता होती है।
(iii) मेंडेलीव की आवर्त सारणी में सात अवधियाँ (१ से) तक) या, क्षैतिज पंक्तियाँ हैं।
Importance of Mendeleev’s Periodic Table
(i) इससे तत्वों का अध्ययन इस अर्थ में काफी व्यवस्थित हो गया कि यदि किसी विशेष समूह में एक तत्व के गुणों को जाना जाता है, तो दूसरों को इसका अनुमान लगाया जा सकता है।
(ii) इससे बाद के चरण में इन तत्वों की खोज में काफी हद तक मदद मिली।
(iii) मेंडेलीव ने अपने अपेक्षित पदों और गुणों की मदद से कुछ तत्वों के परमाणु द्रव्यमान को सही किया।
- Defects in Mendeleev’s Periodic Table in class 11 chemistry chapter 3 notes
(i) हाइड्रोजन को क्षार धातुओं के साथ समूह IA में रखा गया है। लेकिन यह कई गुणों में समूह VII A के हलोजन जैसा दिखता है। इस प्रकार, इसकी स्थिति मेंडेलीव की आवर्त सारणी विवादास्पद है।
(ii) यद्यपि मेंडेलीव की आवर्त सारणी में तत्वों को उनके परमाणु द्रव्यमान के क्रम में व्यवस्थित किया गया है, लेकिन कुछ मामलों में उच्च परमाणु द्रव्यमान वाले तत्व निम्न परमाणु द्रव्यमान के साथ तत्व को पहले ले जाते हैं।
(iii) हम जानते हैं कि किसी तत्व के समस्थानिकों में भिन्न परमाणु द्रव्यमान होते हैं लेकिन एक ही परमाणु संख्या होती है। चूंकि, आवधिक तालिका को तत्वों के बढ़ते परमाणु द्रव्यमान के आधार पर तैयार किया गया है, इसलिए किसी विशेष तत्व के सभी समस्थानिकों को अलग-अलग पद आवंटित किए गए होंगे।
(iv) मेंडेलीव के अनुसार, एक ही समूह में रखे गए तत्वों को उनके गुणों में समान होना चाहिए। लेकिन किसी विशेष समूह के दो उप-समूहों में तत्वों के बीच कोई समानता नहीं है।
(v) कुछ मामलों में, समान गुणों वाले तत्वों को विभिन्न समूहों में रखा गया है।
(vi) एक उचित कारण बताए बिना आवर्त सारणी के नीचे दो अलग-अलग पंक्तियों में लांथनॉइड्स और एक्टिनोइड्स को रखा गया था।
(vii) इस तथ्य के लिए कोई उचित स्पष्टीकरण नहीं दिया गया है कि समूह में रखे गए तत्व उनके गुणों में समानता क्यों दिखाते हैं।
 |
| mendeleev's periodic table |
• modern periodic law in hindi
तत्वों के भौतिक और रासायनिक गुण उनके परमाणु संख्याओं के आवधिक कार्य हैं।
• आवर्त सारणी का वर्तमान रूप (आवर्त सारणी का लंबा रूप)
आवर्त सारणी का लंबा रूप, जिसे मॉडेम आवर्त सारणी भी कहा जाता है, आधुनिक आवर्त नियम पर आधारित है। इस तालिका में परमाणु संख्या बढ़ाने के लिए तत्वों की व्यवस्था की गई है।
• 100 से अधिक परमाणु संख्या वाले तत्वों का नामकरण
 |
| naming of element in periodic table |
• Structural Features of the Periodic Table
- समूहों
आवर्त सारणी के लंबे रूप में ऊर्ध्वाधर पंक्तियाँ भी होती हैं जिन्हें समूह कहा जाता है। आवर्त सारणी में सभी 18 समूहों में हैं। मेंडेलीव आवधिक तालिका के विपरीत, प्रत्येक समूह एक स्वतंत्र समूह है।
- समूहों के लक्षण:
(i) समूह में मौजूद सभी तत्वों में परमाणुओं का समान सामान्य इलेक्ट्रॉनिक विन्यास होता है।
(ii) समूह में तत्व परमाणु संख्याओं के निश्चित अंतराल (2, 8, 8,18, 18,32) से अलग हो जाते हैं।
(iii) समूह में तत्वों के परमाणु आकार गोले की संख्या में वृद्धि के कारण समूह में वृद्धि करते हैं।
(iv) तत्वों के भौतिक गुण जैसे m.p., b.p. घनत्व, घुलनशीलता आदि, एक व्यवस्थित पैटर्न का पालन करते हैं।
(v) प्रत्येक समूह के तत्वों में आम तौर पर समान रासायनिक गुण होते हैं।
- Periods
एक आवर्त सारणी में क्षैतिज पंक्तियों को अवधियों के रूप में जाना जाता है।
आवर्त सारणी के लंबे रूप में सभी सात अवधियों में हैं।
Characteristics of periods for class 11 chemistry notes:
(i) एक अवधि में उपस्थित सभी तत्वों में, इलेक्ट्रॉनों को समान वैल्यू शेल में भरा जाता है।
(ii) परमाणु आकार आमतौर पर बाएं से दाएं घटता है।
s- ब्लॉक तत्व
सामान्य इलेक्ट्रॉनिक कॉन्फ़िगरेशन:
s-Block Elements: ns1-2
(i) सभी तत्व नरम धातु हैं।
(ii) उनके कम गलनांक और क्वथनांक होते हैं।
(iii) वे अत्यधिक प्रतिक्रियाशील होते हैं।
(iv) उनमें से अधिकांश ज्योति को रंग प्रदान करते हैं।
(v) वे आम तौर पर आयनिक यौगिक बनाते हैं।
(vi) वे ऊष्मा और विद्युत के सुचालक होते हैं। पी-ब्लॉक तत्व
सामान्य इलेक्ट्रॉनिक कॉन्फ़िगरेशन:
ns2np1-6
Characteristics of p-block elements:
(i) इन तत्वों के यौगिक ज्यादातर प्रकृति में सहसंयोजक होते हैं।
(ii) वे परिवर्तनशील ऑक्सीकरण अवस्थाएँ दिखाते हैं।
(iii) किसी अवधि में बाएं से दाएं जाने पर, तत्वों का गैर-धातु चरित्र बढ़ता है।
(iv) समूह में तत्वों की प्रतिक्रियाशीलता सामान्यतः नीचे की ओर घटती है।
(v) प्रत्येक अवधि के अंत में एक अच्छा गैस तत्व है जिसमें एक बंद वैलेंस शेल ns2 np6 कॉन्फ़िगरेशन है।
(vi) जैसे ही हम समूह से नीचे जाते हैं, धात्विक चरित्र बढ़ता जाता है।
- d-Block Elements in Chemistry
सामान्य इलेक्ट्रॉनिक कॉन्फ़िगरेशन:
: (n -1) d1-10 ns0-2
डी-ब्लॉक तत्वों को संक्रमण तत्वों के रूप में जाना जाता है क्योंकि उनके पास अपनी जमीनी अवस्था में या किसी भी ऑक्सीकरण अवस्था में डी-ऑर्बिटल्स भरे हुए हैं।
डी-ब्लॉक तत्वों की विशेषताएं:
(i) वे सभी धातुएँ हैं जिनमें उच्च गलनांक और क्वथनांक होते हैं।
(ii) तत्वों के यौगिक आमतौर पर प्रकृति में पैरामैग्नेटिक होते हैं।
(iii) वे ज्यादातर रंगीन आयन बनाते हैं, वैरिएबल वैलेन्स (ऑक्सीडेशन स्टेट्स) दिखाते हैं।
(iv) वे उत्प्रेरक के रूप में दस प्रकार के होते हैं।
- f-Block Elements chemistry notes in Hindi
सामान्य इलेक्ट्रॉनिक कॉन्फ़िगरेशन:
(n – 2) f1-14 (n -1) d0-1 ns2
वे आंतरिक संक्रमण तत्वों के रूप में जाने जाते हैं क्योंकि डी-ब्लॉक के संक्रमण तत्वों में, इलेक्ट्रॉनों को (n - 1)d उप-शेल में भरा जाता है, जबकि एफ-ब्लॉक के आंतरिक संक्रमण तत्वों में इलेक्ट्रॉनों के भरने में होता है (n - 2)f सबशेल, जो एक इनर सबशेल होता है। एफ-ब्लॉक तत्वों की विशेषताएं:
(i) आवर्त सारणी के तल पर तत्वों की दो पंक्तियाँ, जिन्हें लैंथनॉइड सी (जेड = 58) - लू (जेड = 71) और एक्टिनॉइड्स थ (जेड = 90) - एलआर (जेड = 103) कहा जाता है।
(ii) तत्वों की इन दो श्रृंखलाओं को इनर ट्रांजिशन एलिमेंट्स (f-Block Elements) कहा जाता है।
(iii) वे सभी धातु हैं। प्रत्येक श्रृंखला के भीतर, तत्वों के गुण काफी समान हैं।
(iv) अधिकाँश तत्व एक्टिनोइड श्रृंखला प्रकृति में रेडियो सक्रिय हैं।
• Metals
(i) धातु में सभी ज्ञात तत्वों का 78% से अधिक हिस्सा होता है और आवर्त सारणी के बाईं ओर दिखाई देता है।
(ii) धातुएँ कमरे के तापमान पर ठोस होती हैं।
(iii) धातु में आमतौर पर उच्च गलनांक और क्वथनांक होते हैं।
(iv) वे ऊष्मा और विद्युत के सुचालक होते हैं।
(यू) वे निंदनीय और नमनीय हैं।
• Non-metals
(i) गैर-धातुएँ आवर्त सारणी के ऊपरी दाएँ हाथ की ओर स्थित होती हैं।
(ii) गैर-धातुएं आमतौर पर कम पिघलने और क्वथनांक वाले कम तापमान पर ठोस या गैस होती हैं।
(iii) वे ऊष्मा और विद्युत के निर्वाहक होते हैं।
(iv) गैर-धात्विक चरित्र बढ़ता है क्योंकि एक समय-समय पर बाएं से दाएं जाता है
तालिका।
(v) अधिकांश गैर-धात्विक ठोस भंगुर होते हैं और न तो निंदनीय होते हैं और न ही तन्य होते हैं।
- Metalloids
तत्व (जैसे, सिलिकॉन, जर्मेनियम, आर्सेनिक, एंटीमनी और टेल्यूरियम) दोनों धातुओं और गैर-धातुओं की विशेषता दर्शाते हैं। इन तत्वों को सेमीमेटल भी कहा जाता है।
- Noble Gases
- ये समूह 18 में मौजूद तत्व हैं।
- ईश काल महान गैस तत्व के साथ समाप्त होता है।
- सभी सदस्य गैसीय प्रकृति के हैं और सभी कब्जे से भरे ऑर्बिटल्स की उपस्थिति के कारण, उनके पास रासायनिक संयोजन में भाग लेने की बहुत कम प्रवृत्ति है।
- इन्हें अक्रिय गैस भी कहा जाता है।
- Representative Elements
समूह 1 (क्षार धातु), समूह 2 (क्षारीय पृथ्वी धातु) और समूह 13 से 17 के तत्व प्रतिनिधि तत्व बनाते हैं। वे एस-ब्लॉक और पी-ब्लॉक के तत्व हैं।
• संक्रमण तत्व
संक्रमण तत्वों में सभी डी-ब्लॉक तत्व शामिल हैं और वे एस और पी-ब्लॉक तत्वों के बीच आवर्त सारणी के केंद्र में मौजूद हैं।
• आंतरिक संक्रमण तत्व
Lanthanoids (Lanthanum के बाद के चौदह तत्व) और actinides (actinium के बाद चौदह तत्व) को आंतरिक संक्रमण तत्व कहा जाता है। उन्हें एफ-ब्लॉक तत्व भी कहा जाता है।
यूरेनियम के बाद के तत्वों को ट्रांसयूरानिक तत्व भी कहा जाता है।
- Periodic Trends in Properties of Elements For class 11 chemistry notes
भौतिक गुणों में रुझान
परमाणु रेडी: इसे नाभिक के केंद्र से इलेक्ट्रॉनों वाले सबसे बाहरी शेल तक की दूरी के रूप में परिभाषित किया गया है। इस बात पर निर्भर करता है कि कोई तत्व एक गैर-धातु या एक धातु है, तीन अलग-अलग प्रकार के परमाणु रेडी का उपयोग किया जाता है।
ये:
(ए) सहसंयोजक त्रिज्या (बी) आयनिक त्रिज्या (सी) वैन डेर वाल्स त्रिज्या (डी) धातु त्रिज्या।
(ए) सहसंयोजक त्रिज्या: यह विशुद्ध रूप से सहसंयोजक एकल बंधन द्वारा एक साथ रखे गए दो परमाणुओं के नाभिक के केंद्रों के बीच की दूरी के आधे के बराबर है।
(b) आयनिक त्रिज्या: इसे आयन के नाभिक के नाभिक से दूरी के रूप में परिभाषित किया जा सकता है, जिसका आयनिक बंधन में प्रभाव होता है।
(c) वैन डेर वाल्स रेडियस: नोबल गैसों के परमाणुओं को आकर्षण के कमजोर वैन डेर वाल्स बलों द्वारा एक साथ रखा जाता है। वैन डेर वाल्स त्रिज्या महान गैसों के परमाणुओं के केंद्र के बीच की दूरी का आधा है।
(d) धात्विक त्रिज्या: इसे धात्विक जाली में दो निकटवर्ती धातु आयनों के बीच अंतरंग दूरी के आधे के रूप में परिभाषित किया गया है।
• आवर्त सारणी में परमाणु त्रिज्या का परिवर्तन
एक अवधि में भिन्नता: एक अवधि के साथ, तत्वों की परमाणु त्रिज्या आमतौर पर बाएं से दाएं घट जाती है।
एक समूह में भिन्नता: आवर्त सारणी के प्रत्येक समूह में तत्वों की परमाणु त्रिज्या नीचे की ओर बढ़ने पर बढ़ जाती है।
• आयोनिक रेडियस
आयनिक रेडी का अनुमान आयनिक क्रिस्टल में पिंजरों और आयनों के बीच की दूरी को मापने के द्वारा लगाया जा सकता है।
सामान्य तौर पर, तत्वों की आयनिक रेडियो परमाणु राडी के समान प्रवृत्ति प्रदर्शित करते हैं।
Cation: एक परमाणु से एक इलेक्ट्रॉन को हटाने से एक cation का निर्माण होता है। कटियन की त्रिज्या परमाणु की तुलना में हमेशा छोटी होती है।
आयनों: एक इलेक्ट्रॉन की प्राप्ति से एक आयन होता है। आयन का त्रिज्या परमाणु के उस an से हमेशा बड़ा होता है।
Isoelectronic Species: कुछ परमाणु और आयन जिनमें समान इलेक्ट्रॉनों की संख्या होती है, हम उन्हें इयोइलेक्ट्रोनिक प्रजाति कहते हैं। उदाहरण के लिए, O2-, F–, Na + और Mg2 + में इलेक्ट्रॉनों की समान संख्या (10) है। उनके अलग-अलग परमाणु आवेशों के कारण उनकी राड अलग होगी।
• Ionization Enthalpy
यह अपनी जमीन की स्थिति में एक अलग गैसीय परमाणु से एक इलेक्ट्रॉन को निकालने के लिए आवश्यक ऊर्जा है।
M (g) + I.E->> M + (g) + e-
आयनीकरण तापीय धारिता की इकाई केजे मोल -1 है और आयनीकरण क्षमता की इकाई प्रति परमाणु इलेक्ट्रॉन वोल्ट है।
Successive Ionization Enthalpies
यदि एक गैसीय परमाणु एक से अधिक इलेक्ट्रॉनों को खोना है, तो उन्हें एक के बाद एक हटा दिया जा सकता है, अर्थात् उत्तराधिकार में और एक साथ नहीं। इसे क्रमिक आयनीकरण थैलीपी (या संभावित) के रूप में जाना जाता है।
 |
| Enthalpies for class 11 chemistry notes |
- Variation of Ionization Enthalpies in the Periodic Table:
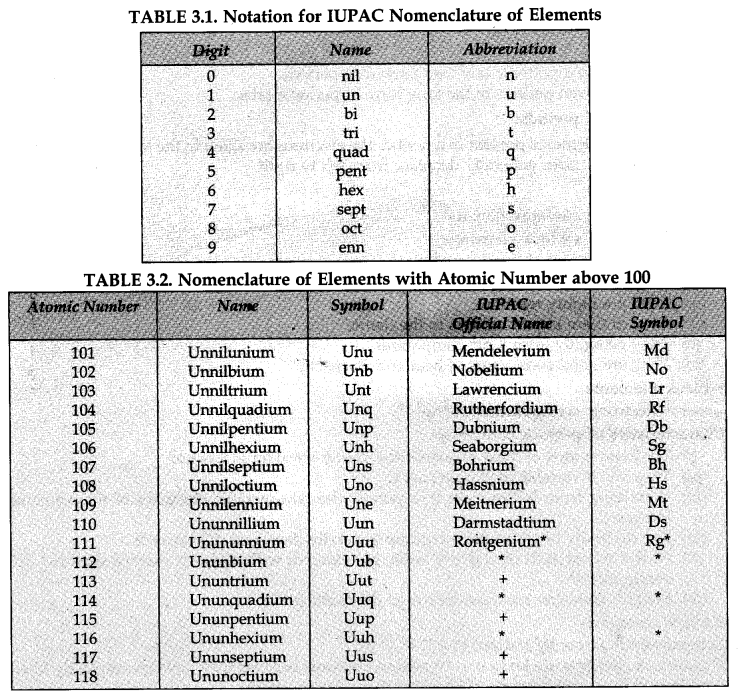
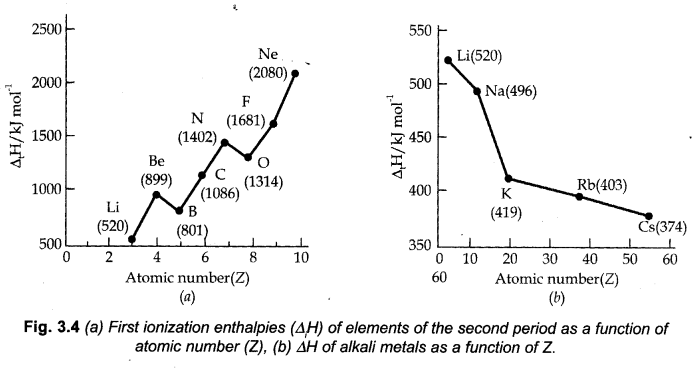
Variation of Ionization Enthalpy Along a Period
एक अवधि के दौरान आयनीकरण थैलेपीज़ को बाएं से दाएं तरफ बढ़ने में वृद्धि की उम्मीद है, क्योंकि परमाणु प्रभार बढ़ता है और परमाणु आकार घट जाता है।
Variation of Ionization Ethalpy in a Group
किसी भी समूह में ऊपर से नीचे जाने पर तत्वों के आयनीकरण की थैलेपीज़ कम हो जाती हैं।
किसी भी समूह के आयनीकरण में कमी के कारण निम्नलिखित कारकों में से एक है।
(i) एक तत्व से दूसरे तक जाने में मुख्य ऊर्जा के गोले (n) की संख्या में वृद्धि होती है।
(ii) आंतरिक इलेक्ट्रॉनों की संख्या में क्रमिक वृद्धि के कारण स्क्रीनिंग प्रभाव की भयावहता में भी वृद्धि होती है।
 |
| class 11 chemistry chapter 3 notes |
- Electron Gain Enthalpy in Chemistry
इलेक्ट्रॉन गेन एनथेल्पी वह ऊर्जा है जब एक इलेक्ट्रॉन को एक पृथक गैसीय परमाणु में जोड़ा जाता है ताकि इसे एक नकारात्मक आयन में परिवर्तित किया जा सके। इस प्रक्रिया को इस प्रकार दर्शाया गया है:
 |
| Electron Gain Enthalpy |
अधिकांश तत्वों के लिए इलेक्ट्रॉन हासिल करना थैलीसीपी नकारात्मक है। उदाहरण के लिए, हैलोजेन के लिए इलेक्ट्रॉन लाभ बहुत अधिक नकारात्मक है क्योंकि वे एक अतिरिक्त इलेक्ट्रॉन को स्वीकार करके निकटतम महान गैस विन्यास प्राप्त कर सकते हैं।
इसके विपरीत, महान गैसों में बड़े सकारात्मक इलेक्ट्रॉन लाभ होते हैं क्योंकि अतिरिक्त इलेक्ट्रॉन को अगले उच्च प्रिंसिपल क्वांटम ऊर्जा के स्तर पर रखना पड़ता है, जिससे अत्यधिक अस्थिर इलेक्ट्रॉनिक कॉन्फ़िगरेशन होता है।
- Successive Electron Gain Enthalpies
हमने अध्ययन किया है कि एक गैसीय परमाणुओं से इलेक्ट्रॉनों को उत्तराधिकार में खो दिया जाता है (यानी, एक के बाद एक)। इसी तरह, ये भी एक के बाद एक स्वीकार किए जाते हैं, अर्थात् उत्तराधिकार में। एक इलेक्ट्रॉन के जुड़ने के बाद, परमाणु ऋणात्मक रूप से आवेशित हो जाता है और दूसरे इलेक्ट्रॉन को ऋणात्मक रूप से आवेशित आयन में जोड़ना होता है।
लेकिन दूसरे इलेक्ट्रॉन के जोड़ को इलेक्ट्रोस्टैटिक प्रतिकर्षण द्वारा विरोध किया जाता है और इसलिए दूसरे इलेक्ट्रॉन को जोड़ने के लिए ऊर्जा की आपूर्ति की जाती है। इस प्रकार एक तत्व का दूसरा इलेक्ट्रॉन लाभ सकारात्मक है।
उदाहरण के लिए, जब ओयन बनाने के लिए ऑक्सीजन परमाणु में एक इलेक्ट्रॉन जोड़ा जाता है, तो ऊर्जा निकलती है। लेकिन जब O2- आयन बनाने के लिए 0- आयन में एक और इलेक्ट्रॉन जोड़ा जाता है,
तो नकारात्मक रूप से चार्ज किए गए 0 आयन और दूसरे इलेक्ट्रॉन के बीच मजबूत इलेक्ट्रोस्टैटिक प्रतिकर्षण को दूर करने के लिए ऊर्जा को अवशोषित किया जाता है। इस प्रकार, पहला इलेक्ट्रॉन लाभ
 |
| class 11 chemistry notes chapter 3 |
- Factors on which Electron Gain Enthalpy Depends
(i) परमाणु का आकार: जैसे ही परमाणु का आकार बढ़ता है, उसके नाभिक और आने वाले इलेक्ट्रॉन के बीच की दूरी भी बढ़ जाती है और इलेक्ट्रॉन हासिल करने की क्षमता कम हो जाती है
(ii) नाभिकीय आवेश: नाभिकीय आवेश में वृद्धि के साथ नाभिक और आने वाले इलेक्ट्रॉन के बीच आकर्षण बल बढ़ता है और इस प्रकार इलेक्ट्रॉन लाभ अधिक नकारात्मक हो जाता है।
(iii) इलेक्ट्रॉनिक कॉन्फ़िगरेशन की समरूपता: सममित विन्यास वाले परमाणुओं (एक ही उप-शेल में पूर्ण रूप से भरे या आधे भरे हुए ऑर्बिटल्स) में अतिरिक्त इलेक्ट्रॉनों को लेने का कोई आग्रह नहीं होता है क्योंकि उनका कॉन्फ़िगरेशन अस्थिर हो जाएगा।
उस स्थिति में ऊर्जा की आवश्यकता होगी और इलेक्ट्रॉन लाभ थैलेपी (Δ उदा एच) सकारात्मक होगा। उदाहरण के लिए, महान गैस तत्वों में सकारात्मक इलेक्ट्रॉन लाभ होता है।
एक अवधि में इलेक्ट्रॉन लाभ Enthalpy के परिवर्तन
एक अवधि में परमाणु संख्या में वृद्धि के साथ इलेक्ट्रॉन लाभ ethalpy अधिक नकारात्मक हो जाता है।
एक समूह में इलेक्ट्रॉन लाभ Enthalpy का परिवर्तन
जब हम किसी समूह में जाते हैं तो इलेक्ट्रान का लाभ कम होता है।
 |
| Variation of Electron Gain Enthalpy in a Group |
• वैद्युतीयऋणात्मकता
साझा किए गए इलेक्ट्रॉनों को खुद को आकर्षित करने के लिए एक रासायनिक परिसर में एक परमाणु की क्षमता का गुणात्मक माप को इलेक्ट्रोनगेटिविटी कहा जाता है। आयनीकरण के विपरीत थैलेपी और इलेक्ट्रॉन हासिल थैलीसी के विपरीत, यह एक औसत दर्जे की मात्रा नहीं है।
हालांकि, तत्वों की विद्युतगुणात्मकता के कई पैमाने, पॉलिंग स्केल, मिलिकेन- जाफ स्केल, एलेड कोचो स्केल विकसित किए गए हैं। किसी दिए गए तत्व की इलेक्ट्रोनगेटिविटी स्थिर नहीं है; यह उस तत्व के आधार पर भिन्न होता है जिसके लिए वह बाध्य है।
एक अवधि के पार
इलेक्ट्रोनगेटिविटी आम तौर पर बाएं से दाएं की अवधि में बढ़ती है।
एक समूह में
यह एक समूह को घटाता है।
 |
| Electronegativity value |
- Periodic Trends in Chemical Properties along a Period for class 11 chemistry notes chapter 3
(i) धातु वर्ण: चरम बाएँ (क्षार धातुओं) पर अधिकतम अवधि में कमी।
(ii) गैर-धातु वर्ण: एक अवधि के साथ वृद्धि। (बाएं से दाएं)।
(iii) ऑक्साइड की मूल प्रकृति: किसी अवधि में बाएं से दाएं की ओर घटती है।
(iv) आक्साइड की अम्लीय प्रकृति: एक अवधि में बाएं से दाएं बढ़ जाती है।
- एक समूह के नीचे जाने पर ऊपर से नीचे तक विविधता(Variation from Top to Bottom on Moving Down a Group)
(i) धातु वर्ण। आम तौर पर बढ़ जाती है क्योंकि परमाणु आकार में वृद्धि और इसलिए ऊपर से नीचे एक समूह में तत्वों की आयनिज़ेयॉर्ट ऊर्जा में कमी।
(ii) गैर-धातु वर्ण। आम तौर पर एक समूह कम हो जाता है। जैसे किसी समूह में तत्वों की विद्युत अपघटनी ऊपर से नीचे की ओर घटती है।
(iii) ऑक्साइड की मूल प्रकृति। चूंकि धातु समूह या तत्वों की इलेक्ट्रोपोसिटिविटी एक समूह में ऊपर से नीचे की ओर बढ़ती है, इसलिए ऑक्सीकरण की मूल प्रकृति स्वाभाविक रूप से बढ़ जाती है।
(iv) आक्साइड का अम्लीय वर्ण। आम तौर पर घटता है क्योंकि एक समूह में ऊपर से नीचे जाने में तत्वों के गैर-धातु वाले चरित्र घट जाते हैं।
(v) धातुओं की अभिक्रियाशीलता। आम तौर पर एक समूह में वृद्धि होती है। चूंकि इलेक्ट्रॉन खोने की प्रवृत्ति बढ़ जाती है।
(vi) गैर-धातुओं की प्रतिक्रिया। आम तौर पर समूह में कमी होती है, गैर-धातुओं की विद्युत-नकारात्मकता, उनकी प्रतिक्रिया अधिक होती है। चूंकि एक समूह में गैर-धातुओं की विद्युतगतिशीलता ऊपर से नीचे तक घट जाती है, इसलिए उनकी प्रतिक्रियाशीलता भी घट जाती है।
- Anomalous Properties of Second Period Elements For chemistry notes in Hindi
समूह 1 (लिथियम) और 2 (बेरिलियम) और समूह 13-17 (फ्लोरीन) के प्रत्येक समूह का पहला तत्व उनके संबंधित समूहों के अन्य सदस्यों से कई मामलों में अलग है। उदाहरण के लिए, अन्य क्षार धातुओं के विपरीत लिथियम और अन्य क्षारीय पृथ्वी धातुओं के विपरीत बेरिलियम
फार्म यौगिकों में महत्वपूर्ण सहसंयोजक चरित्र होता है; इन समूहों के अन्य सदस्य, पूर्व-अधिमानतः आयनिक यौगिक बनाते हैं।
यह देखा गया है कि दूसरी अवधि के कुछ तत्व तीसरे समूहों के तत्वों के साथ समानता दिखाते हैं, जो अलग-अलग समूहों से संबंधित होते हुए भी एक-दूसरे के विपरीत हैं।
उदाहरण के लिए,
एक दूसरे के तिरछे रखे गए तत्वों के गुणों में इस समानता को विकर्ण संबंध कहा जाता है।
• मेंडेलीव का आवधिक कानून। तत्वों के भौतिक और रासायनिक गुण उनके परमाणु द्रव्यमानों के आवधिक कार्य हैं।
• मोडेम आवधिक कानून। तत्वों के भौतिक और रासायनिक गुण उनके परमाणु संख्या के आवधिक कार्य हैं।
• समूह। 18 समूह हैं। ये लंबवत पंक्तियाँ हैं।
• पीरियड्स। 7 काल हैं। ये क्षैतिज पंक्तियाँ हैं।
• प्रतिनिधि तत्व। तत्वों का S और P ब्लॉक प्रतिनिधि तत्वों के रूप में जाना जाता है।
• संक्रमण तत्व। उन्हें डी-ब्लॉक तत्व भी कहा जाता है। उनके पास सामान्य इलेक्ट्रॉनिक कॉन्फ़िगरेशन (n - 1) d1-10 ns0-2 है।
• आंतरिक संक्रमण तत्व। Lanthanoids (Lanthanum के बाद के चौदह तत्व) और actinides (actinium के बाद चौदह तत्व) को आंतरिक संक्रमण तत्व कहा जाता है। सामान्य इलेक्ट्रॉनिक कॉन्फ़िगरेशन है (n – 2) f1-14(n – 1) d0-1 ns2.
उन्हें एफ-ब्लॉक तत्व भी कहा जाता है।
• धातु। आवर्त सारणी के बाईं ओर प्रस्तुत करें। ज्ञात तत्वों का 78% से अधिक हिस्सा।
• गैर-धातु। ज्यादातर आवर्त सारणी के दायीं ओर स्थित है।
• धातुरूप। वे तत्व जो धातुओं और गैर-धातुओं के बीच की सीमा रेखा के रूप में (जैसे, सी, जीई, एस) को मेटलॉयड या सेमीमीटर कहते हैं।
• परमाणु रेडी और आयनिक रेडी, अवधि के साथ समूह की कमी को बढ़ाते हैं।
• Ionization Enthalpy। अवधि के साथ बढ़ता है और समूह को घटाता है।
• नोबल गैस तत्व। सममित विन्यास वाले तत्व प्रकृति में रासायनिक रूप से निष्क्रिय हैं।
• इलेक्ट्रिक न्यूक्लियर चार्ज। Z = परमाणु आवेश - स्क्रीनिंग स्थिरांक।
• वैद्युतीयऋणात्मकता। एक अवधि के साथ बढ़ता है समूह के नीचे घट जाती है,
• रासायनिक प्रतिक्रिया। रासायनिक अभिक्रियाशीलता किसी अवधि के दो चरम पर और केंद्र में सबसे कम होती है।
• तत्वों के ऑक्साइड। बाईं ओर तत्वों से बने ऑक्साइड मूल और तत्वों के होते हैं
दाईं ओर प्रकृति में अम्लीय हैं।
केंद्र में तत्वों के ऑक्साइड एम्फोटेरिक या न्यूट्रल हैं।










No comments:
Post a Comment