Some Basic Concepts of class 11 chemistry chapter 1 notes
केमिस्ट्री क्लास 11 नोट्स अध्याय 1 के कुछ बुनियादी अवधारणा
• रसायन विज्ञान का महत्व
रसायन विज्ञान का हमारे जीवन पर सीधा प्रभाव पड़ता है और विभिन्न क्षेत्रों में अनुप्रयोगों की एक विस्तृत श्रृंखला होती है। ये नीचे दिए गए हैं:
(A) In Agriculture and Food:
(i) इसने यूरिया, कैल्शियम फॉस्फेट, सोडियम नाइट्रेट, अमोनियम फॉस्फेट आदि रासायनिक उर्वरक प्रदान किए हैं।
(ii) कुछ प्रभावी कीटनाशकों, फफूंदनाशकों और कीटनाशकों के उपयोग से फसलों को कीड़ों और हानिकारक जीवाणुओं से बचाने में मदद मिली है।
(iii) परिरक्षकों के उपयोग से खाद्य उत्पादों जैसे जैम, मक्खन, स्क्वैश आदि को अधिक समय तक संरक्षित रखने में मदद मिली है।
Check also :- class 10 history chapter 2 notes pdf in Hindi
(B) In Health and Sanitation class 11 chemistry chapter 1 notes:
(i) इसने मानव जाति को बड़ी संख्या में जीवनरक्षक दवाएं प्रदान की हैं। आज, सल्फा दवाओं और पेनिसिलिन जीवन रक्षक दवाओं की खोज के कारण पेचिश और निमोनिया का इलाज होता है। सिस्प्लैटिन और टैक्सोल कैंसर चिकित्सा के लिए बहुत प्रभावी पाए गए हैं और एड्स पीड़ितों के लिए AZT (Azidothymidine) का उपयोग किया जाता है।
(ii) नालियों जैसे शौचालय, फर्श आदि में मौजूद सूक्ष्म जीवों को मारने के लिए फिनोल का उपयोग किया जाता है।
(iii) क्लोरीन की कम सांद्रता यानि 0.2 से 0.4 भाग प्रति मिलियन (पीपीएम) का उपयोग पानी के नसबंदी के लिए किया जाता है ताकि इसे पीने के लिए उपयुक्त बनाया जा सके।
(C) Saving the Environment:
पूरी दुनिया में तेजी से हो रहे औद्योगिकीकरण के परिणामस्वरूप बहुत प्रदूषण हुआ है।
वायुमंडल में जहरीली गैसों और रसायनों को लगातार छोड़ा जा रहा है।
वे खतरनाक दर पर पर्यावरण को प्रदूषित कर रहे हैं। वैज्ञानिक विकल्प विकसित करने के लिए दिन-रात काम कर रहे हैं जिससे कम प्रदूषण हो सकता है।
उदाहरण के लिए, CNG (संपीड़ित प्राकृतिक गैस), पेट्रोल का एक विकल्प है, जो ऑटोमोबाइल के कारण होने वाले प्रदूषण की जाँच करने में बहुत प्रभावी है।
(D) Application in Industry:
रसायन विज्ञान ने कई औद्योगिक रूप से विकसित होने में महत्वपूर्ण भूमिका निभाई है ^ निर्मित उर्वरक, क्षार, एसिड, लवण, रंजक, पॉलिमर, ड्रग्स, साबुन,
नई सामग्री सहित डिटर्जेंट, धातु मिश्र धातु और अन्य अकार्बनिक और कार्बनिक रसायन राष्ट्रीय अर्थव्यवस्था में बड़े पैमाने पर योगदान करते हैं।
• Matter For class 11 chemistry chapter 1 notes
किसी भी चीज का द्रव्यमान और स्थान घेरता है, पदार्थ कहलाता है।
उदाहरण के लिए, पुस्तक, पेंसिल, पानी, हवा पदार्थ से बने होते हैं जैसा कि हम जानते हैं कि उनके पास है
द्रव्यमान और वे अंतरिक्ष पर कब्जा करते हैं।
• Classification of Matter
मामले को वर्गीकृत करने के दो तरीके हैं:
(ए) शारीरिक वर्गीकरण
(बी) रासायनिक वर्गीकरण
(ए) शारीरिक वर्गीकरण:
states of matter class 11 notes
पदार्थ तीन भौतिक अवस्थाओं में मौजूद हो सकता है:
1. ठोस 2. तरल पदार्थ 3. गैसें
1. ठोस: कणों को व्यवस्थित रूप से एक-दूसरे के बहुत पास रखा जाता है और उनमें आवागमन की अधिक स्वतंत्रता नहीं होती है।
ठोस के लक्षण: ठोस में निश्चित मात्रा और निश्चित आकार होता है।
2. तरल पदार्थ: तरल पदार्थ में, कण एक दूसरे के करीब होते हैं लेकिन चारों ओर घूम सकते हैं। तरल पदार्थ के लक्षण: तरल पदार्थ की निश्चित मात्रा होती है लेकिन निश्चित आकार नहीं।
3. गैसें: गैसों में, ठोस या तरल अवस्था में मौजूद कणों की तुलना में कण अलग होते हैं। उनका आंदोलन आसान और तेज है।
गैसों की विशेषताएँ: गैसों की न तो निश्चित मात्रा होती है और न ही निश्चित आकार। वे उस कंटेनर पर पूरी तरह से कब्जा कर लेते हैं जिसमें उन्हें रखा गया है।
(b) रासायनिक वर्गीकरण class 11 chemistry chapter 1 notes in hindi pdf:
संरचना के आधार पर, पदार्थ को दो मुख्य प्रकारों में विभाजित किया जा सकता है:
1. शुद्ध पदार्थ 2. मिश्रण।
1. शुद्ध पदार्थ: एक शुद्ध पदार्थ को एकल पदार्थ (या पदार्थ) के रूप में परिभाषित किया जा सकता है जिसे सरल भौतिक तरीकों से अलग नहीं किया जा सकता है।
शुद्ध पदार्थों को आगे (i) तत्वों (ii) यौगिकों के रूप में वर्गीकृत किया जा सकता है
(i) तत्व: एक तत्व में केवल एक प्रकार के कण होते हैं। ये कण परमाणु या अणु हो सकते हैं।
उदाहरण के लिए, सोडियम, तांबा, चांदी, हाइड्रोजन, ऑक्सीजन आदि तत्व के कुछ उदाहरण हैं। उन सभी में एक प्रकार के परमाणु होते हैं।
हालांकि, प्रकृति में विभिन्न तत्वों के परमाणु अलग-अलग हैं। कुछ तत्व जैसे सोडियम। या तांबे में एकल परमाणुओं को उनके घटक कणों के रूप में एक साथ रखा जाता है, जबकि कुछ अन्य में दो या अधिक परमाणु तत्व के अणु देने के लिए गठबंधन करते हैं।
इस प्रकार, हाइड्रोजन, नाइट्रोजन और ऑक्सीजन गैसों में अणुओं से मिलकर बनता है जिसमें तत्व के संबंधित अणुओं को देने के लिए दो परमाणु गठबंधन करते हैं।
(ii) यौगिक: इसे एक शुद्ध पदार्थ के रूप में परिभाषित किया जा सकता है जिसमें दो या दो से अधिक तत्वों को एक साथ एक निश्चित अनुपात में वजन द्वारा जोड़ा जाता है और उपयुक्त रासायनिक विधियों द्वारा इन तत्वों में विघटित किया जा सकता है। इसके अलावा, एक यौगिक के गुण पूरी तरह से निम्नलिखित तत्वों से भिन्न होते हैं।
यौगिकों को दो प्रकारों में वर्गीकृत किया गया है। ये:
(i) अकार्बनिक यौगिक: ये ऐसे यौगिक हैं जो निर्जीव स्रोतों जैसे चट्टानों और खनिजों से प्राप्त होते हैं। कुछ
उदाहरण हैं: आम नमक, संगमरमर, जिप्सम, वाशिंग सोडा आदि।
(ii) कार्बनिक यौगिक ऐसे यौगिक हैं जो पौधों और जानवरों में मौजूद होते हैं। सभी कार्बनिक यौगिकों में कार्बन को उनके आवश्यक घटक के रूप में पाया गया है। उदाहरण के लिए, कार्बोहाइड्रेट, प्रोटीन, तेल, वसा आदि।
2. मिश्रण: दो या दो से अधिक तत्वों या यौगिकों का संयोजन जो रासायनिक रूप से एक साथ नहीं होते हैं और किसी भी अनुपात में मौजूद हो सकते हैं, मिश्रण कहलाता है। मिश्रण के कुछ उदाहरण हैं: दूध, समुद्र का पानी, पेट्रोल, चूने का पानी, पेंट ग्लास, सीमेंट, लकड़ी आदि।
मिश्रण के प्रकार: मिश्रण दो प्रकार के होते हैं:
(i) सजातीय मिश्रण: एक मिश्रण को सजातीय कहा जाता है यदि इसमें एक समान रचना है और घटकों के बीच अलगाव की कोई दृश्य सीमा नहीं है।
उदाहरण के लिए: पानी में चीनी के घोल के मिश्रण में चीनी की पानी की संरचना समान होती है और सभी भागों में समान मिठास होती है।
(ii) विषम मिश्रण: एक मिश्रण को विषम कहा जाता है यदि इसमें एक समान संरचना नहीं होती है और विभिन्न घटकों के बीच अलगाव की दृश्य सीमाएं होती हैं। विषम मिश्रण के विभिन्न घटकों को नग्न आंखों से भी देखा जा सकता है।
उदाहरण के लिए: जब लोहे के बुरादे और सल्फर पाउडर को एक साथ मिलाया जाता है, तो गठित मिश्रण विषम होता है। इसमें ग्रेश-पीला रूप है और दो घटक, लोहा और सल्फर, आसानी से नग्न आंखों से पहचाने जा सकते हैं।
• Differences between Compounds and Mixtures class 11 chemistry chapter 1 notes in Hindi
Compounds
1. एक यौगिक में, दो या अधिक तत्व रासायनिक रूप से संयुक्त होते हैं।
2. एक यौगिक में, तत्व द्रव्यमान द्वारा निश्चित अनुपात में मौजूद होते हैं। यह अनुपात बदल नहीं सकता।
3. CompoUnds हमेशा सजातीय होते हैं यानी, उनकी समान रचना होती है।
4 एक परिसर में, भौतिक तरीकों से घटकों को अलग नहीं किया जा सकता है
5. एक कंपाउंड में, घटक अपनी पहचान खो देते हैं यानी, कंपाउंड में निम्न तत्वों की विशेषताएं नहीं दिखाई देती हैं।
Mixtures
1. मिश्रण में, या अधिक तत्व या यौगिक केवल मिश्रित होते हैं और रासायनिक रूप से संयुक्त नहीं होते हैं।
2. एक मिश्रण में घटक निश्चित अनुपात में मौजूद नहीं हैं। यह अलग-अलग हो सकता है
3. मिश्रण प्रकृति में सजातीय या विषम हो सकता है।
4. मिश्रण के क्षेत्रों को भौतिक तरीकों से अलग किया जा सकता है।
5, एक मिश्रण में, घटक अपनी पहचान नहीं खोते हैं यानी, एक मिश्रण सभी घटकों की विशेषताओं को दर्शाता है।
हमने पदार्थ के भौतिक और रासायनिक वर्गीकरण पर चर्चा की है। उसी की एक प्रवाह शीट का प्रतिनिधित्व नीचे दिया गया है।
 |
| Matter |
• Properties of Matter and Their Measurements for chemistry notes in hindi
भौतिक गुण: वे गुण जिनकी पहचान या पदार्थ की संरचना को बदलने के बिना मापा या मनाया जा सकता है।
भौतिक गुणों के कुछ उदाहरण रंग, गंध, गलनांक, क्वथनांक आदि रासायनिक गुण हैं: इसमें होने वाले रासायनिक परिवर्तन की आवश्यकता होती है। रासायनिक गुणों के उदाहरण विभिन्न पदार्थों की विशेषता प्रतिक्रियाएं हैं। इनमें एसिडिटी, बेसिकिटी, कॉम्बिबिलिटी आदि शामिल हैं।
• Units of Measurement
मौलिक इकाइयाँ: मात्राओं की मात्रा, लंबाई और समय को मूलभूत मात्रा कहा जाता है और उनकी इकाइयों को मूलभूत इकाइयों के रूप में जाना जाता है।
मात्राओं के लिए माप की सात बुनियादी इकाइयाँ हैं: लंबाई, द्रव्यमान, समय, तापमान, पदार्थ की मात्रा, विद्युत प्रवाह और चमकदार तीव्रता।
सी-सिस्टम: माप की यह प्रणाली दुनिया भर में कार्यरत सबसे आम प्रणाली है।
इसमें ऊपर सूचीबद्ध सभी सात मूल मात्राओं की इकाइयाँ दी गई हैं।
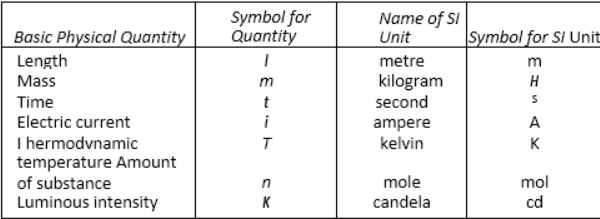 |
| Basic SI Units |
• Definitions of Basic SI Units
1. मीटर: यह एक सेकंड के 1/299792458 के समय अंतराल के दौरान वैक्यूम में प्रकाश द्वारा यात्रा की जाने वाली पथ की लंबाई है।
2. किलोग्राम: यह द्रव्यमान की इकाई है। यह अंतरराष्ट्रीय प्रोटोटाइप के द्रव्यमान के बराबर है
किलोग्राम का। ,
3. सेकंड: यह 9192631 की अवधि है, 770 अवधि के विकिरण, जो कि कैल्सियम के भू-अवस्था के दो अति सूक्ष्म स्तरों- 133 परमाणु के बीच संक्रमण के अनुरूप हैं।
4. केल्विन: यह थर्मोडायनामिक तापमान की इकाई है और पानी के तिहरे बिंदु के थर्मोडायनामिक तापमान के 1 / 273.16 के बराबर है।
5. एम्पीयर: एम्पीयर वह निरंतर करंट होता है जो यदि अनंत लंबाई के दो सीधे समानांतर कंडक्टरों में बनाए रखा जाता है, तो नगण्य वृत्ताकार क्रॉस सेक्शन का और वैक्यूम में 1 मीटर अलग रखा जाता है, इन कंडक्टरों के बीच 2 x 10-7 के बराबर बल उत्पन्न होगा N प्रति मीटर लंबाई।
6. कैंडेला: इसे किसी दिए गए दिशा में चमकदार तीव्रता के रूप में परिभाषित किया जा सकता है, एक स्रोत से जो आवृत्ति 540 x 1012 हर्ट्ज के मोनोक्रोमैटिक विकिरण का उत्सर्जन करता है और उस पर 1/683 वाट प्रति स्टेरेडियन की दिशा में एक गहन तीव्रता होती है।
7. मोल: यह पदार्थ की मात्रा है जिसमें कई प्राथमिक संस्थाएं होती हैं क्योंकि 0.012 किलोग्राम कार्बन -12 में परमाणु होते हैं। इसका प्रतीक 'मोल' है।
• Mass and Weight class 11 chemistry notes in hindi
द्रव्यमान: द्रव्यमान का द्रव्यमान इसमें मौजूद पदार्थ की मात्रा है।
किसी पदार्थ का द्रव्यमान स्थिर होता है।
किसी पदार्थ का द्रव्यमान एक विश्लेषणात्मक का उपयोग करके प्रयोगशाला में सटीक रूप से निर्धारित किया जा सकता है
संतुलन। मास की SI इकाई किलोग्राम है।
 |
| analytical balance |
भार: यह किसी वस्तु पर गुरुत्वाकर्षण द्वारा लगाया गया बल है। गुरुत्वाकर्षण में परिवर्तन के कारण पदार्थ का वजन एक स्थान से दूसरे स्थान पर भिन्न हो सकता है।
वॉल्यूम: वॉल्यूम का मतलब पदार्थ द्वारा कब्जा किए गए स्थान से है। इसकी (लंबाई) 3 की इकाइयाँ हैं। SI इकाइयों में, मात्रा metre3 (m3) में व्यक्त की जाती है। हालांकि, विशेष रूप से तरल पदार्थ में माप की एक लोकप्रिय इकाई लीटर (एल) है, लेकिन यह एसआई इकाइयों या एसआई इकाई में नहीं है।
गणितीय रूप से,
1 एल = 1000ml = 1000cm3 = 1dm3।
तरल पदार्थों की मात्रा को विभिन्न उपकरणों जैसे कि मूत्रवर्धक, पिपेट, सिलेंडर, फ्लास्क को मापने आदि से मापा जा सकता है। इन सभी को कैलिब्रेट किया गया है।.
 |
| some volume measuring device |
तापमान: तीन पैमाने हैं जिनमें तापमान को मापा जा सकता है। इन्हें सेल्सियस पैमाने (° C), फ़ारेनहाइट स्केल (° F) और केल्विन स्केल (K) के रूप में जाना जाता है।
 |
| class 11 chemistry chapter 1 notes in hindi pdf |
-> सेल्सियस पैमाने के साथ थर्मामीटर 0 डिग्री सेल्सियस से 100 डिग्री सेल्सियस तक कैलिब्रेट किए जाते हैं।
-> फारेनहाइट पैमाने के साथ थर्मोमेट्रेस को 32 ° F से 212 ° F तक कैलिब्रेट किया जाता है।
-> केल्विन का तापमान एस.आई. स्केल है और इन दिनों बहुत आम है। इस पैमाने पर तापमान को संकेत डी द्वारा दिखाया गया है।
• Uncertainty in Measurements
सभी वैज्ञानिक मापों में कुछ हद तक त्रुटि या अनिश्चितता होती है। जो त्रुटियां उत्पन्न होती हैं, वे दो कारकों पर निर्भर करती हैं।
(i) कार्यकर्ता की कुशलता और सटीकता (ii) माप उपकरणों की सीमाएँ।
• Scientific Notation
यह एक घातीय संकेतन है जिसमें किसी भी संख्या को N x 10n के रूप में दर्शाया जा सकता है जहाँ n एक धनात्मक या ऋणात्मक मान है और N 1 से 10. के बीच भिन्न हो सकता है। इस प्रकार 232.508 को वैज्ञानिक संकेतन में 2.32508 x 102 के रूप में लिखा जा सकता है।
अब देखते हैं कि वैज्ञानिक अंकन में व्यक्त संख्याओं के साथ गणना कैसे की जाती है।
(i) गुणा और भाग से संबंधित गणना
(ii) जोड़ और घटाव को शामिल करते हुए गणना: इन दोनों परिचालनों के लिए, पहली संख्याओं को इस तरह से लिखा जाता है कि उनका एक ही घातांक होता है। उसके बाद, गुणांक जोड़ दिया जाता है या घटाया जाता है जैसा कि मामला हो सकता है। उदाहरण के लिए,
• Significant Figures class 11 chemistry handwritten notes pdf in hindi
महत्वपूर्ण आंकड़े सार्थक अंक हैं जिन्हें निश्चितता के साथ जाना जाता है। महत्वपूर्ण आंकड़ों की संख्या निर्धारित करने के लिए कुछ नियम हैं। ये नीचे दिए गए हैं:
1. सभी गैर-शून्य अंक महत्वपूर्ण हैं। उदाहरण के लिए, 285 सेमी में, तीन महत्वपूर्ण आंकड़े हैं और 0.25 एमएल में, दो महत्वपूर्ण आंकड़े हैं।
2. पहले गैर-शून्य अंक से पहले के शून्य महत्वपूर्ण नहीं हैं। ऐसा शून्य दशमलव बिंदु की स्थिति को इंगित करता है।
उदाहरण के लिए, 0.03 में एक महत्वपूर्ण आंकड़ा है और 0.0052 में दो महत्वपूर्ण आंकड़े हैं।
3. दो गैर-शून्य अंकों के बीच शून्य महत्वपूर्ण हैं। इस प्रकार, 2.005 के चार महत्वपूर्ण आंकड़े हैं।
4. संख्या के अंत या दाईं ओर शून्य महत्वपूर्ण हैं बशर्ते वे दशमलव बिंदु के दाईं ओर हों। उदाहरण के लिए, 0.200 ग्राम में तीन महत्वपूर्ण आंकड़े हैं।
5. वस्तुओं की संख्या की गिनती। उदाहरण के लिए, 2 गेंदों या 20 अंडों में अनंत महत्वपूर्ण आंकड़े हैं क्योंकि ये सटीक संख्याएं हैं और दशमलव रखने के बाद अनंत संख्या में शून्य लिखकर प्रतिनिधित्व किया जा सकता है।
यानी, 2 = 2.000000
या 20 = 20.000000
• Addition and Subtraction of Significant
Figuresविभिन्न उपसर्गों वाली संख्याओं के अतिरिक्त या घटाव में, अंतिम परिणाम दशमलव स्थानों की उसी संख्या को बताया जाना चाहिए, जिसमें दशमलव स्थानों की संख्या कम से कम हो।
उदाहरण के लिए, आइए हम तीन संख्याओं 3.52, 2.3 और 6.24 को जोड़ते हैं, जिसमें अलग-अलग उपसर्ग या अलग-अलग संख्या में दशमलव स्थान होते हैं।
• Multiplication and Division of Significant Figures
गुणा या भाग में, अंतिम परिणाम कम से कम सटीक संख्या में मौजूद महत्वपूर्ण आंकड़ों के समान बताया जाना चाहिए।
संख्याओं का गुणन: 2.2120 x 0.011 = 0.024332
नियम के अनुसार अंतिम परिणाम = 0.024
संख्याओं का विभाजन: 4.2211 76 3.76 = 1.12263
सही उत्तर = 1.12
• आकार जांच
अक्सर गणना करते समय, इकाइयों को एक प्रणाली से दूसरे में बदलने की आवश्यकता होती है। इसे पूरा करने के लिए उपयोग की जाने वाली विधि को कारक लेबल विधि या इकाई कारक विधि या आयामी विश्लेषण कहा जाता है।
• Laws of Chemical Combinations For class 11 chemistry notes in Hindi
यौगिक बनाने के लिए तत्वों का संयोजन निम्नलिखित पांच बुनियादी कानूनों द्वारा नियंत्रित होता है।
(i) जन संरक्षण का कानून
(ii) निश्चित अनुपात का कानून
(iii) एकाधिक अनुपात का कानून
(iv) गैसीय आयतन का नियम (गे लुसैक का नियम)
(v) अवोगाद्रो का नियम
(i) जन संरक्षण का कानून
कानून की स्थापना एक फ्रांसीसी रसायनज्ञ, ए लवॉज़ियर द्वारा की गई थी। कानून कहता है:
सभी भौतिक और रासायनिक परिवर्तनों में, अभिकारकों का कुल द्रव्यमान उत्पादों के बराबर होता है।
दूसरे शब्दों में, पदार्थ को न तो बनाया जा सकता है और न ही नष्ट किया जा सकता है।
निम्नलिखित प्रयोग इस कानून की सच्चाई को दर्शाते हैं।
(ए) जब पदार्थ एक भौतिक परिवर्तन से गुजरता है।
यह पाया गया है कि वजन में कोई परिवर्तन नहीं है, हालांकि एक शारीरिक परिवर्तन हुआ है।
(b) जब पदार्थ रासायनिक परिवर्तन से गुजरता है।
उदाहरण के लिए, मरक्यूरिक ऑक्साइड का अपघटन।
उपरोक्त अपघटन प्रतिक्रिया के दौरान, पदार्थ न तो प्राप्त होता है और न ही खोया जाता है।
(ii) निश्चित अनुपात का कानून:
इस कानून के अनुसार:
एक शुद्ध रासायनिक यौगिक में हमेशा समान तत्व होते हैं जो वजन द्वारा निश्चित अनुपात में एक साथ संयोजित होते हैं।
उदाहरण के लिए, कार्बन डाइऑक्साइड कई तरीकों से बन सकता है यानी,
(iii) एकाधिक अनुपात का कानून:
यदि दो तत्व दो या दो से अधिक यौगिकों को बनाते हैं, तो एक तत्व का वजन जो इन यौगिकों में दूसरे के निश्चित वजन के साथ मिलकर होता है, वजन द्वारा सरल पूरे संख्या अनुपात को सहन करता है।
(iv) Gay Lussac’s Law of Gaseous Volumes:कानून कहता है कि तापमान और दबाव की समान स्थितियों के तहत, जब भी गैसों का संयोजन होता है, तो वे ऐसे संस्करणों में करते हैं जो एक दूसरे के साथ और गैसीय उत्पादों के साथ सरल पूरे संख्या अनुपात को सहन करते हैं। कानून का उदाहरण निम्नलिखित उदाहरणों से दिया जा सकता है।
(ए) हाइड्रोजन और क्लोरीन के बीच संयोजन:
(b) नाइट्रोजन और हाइड्रोजन के बीच संयोजन: दो गैसें उपयुक्त परिस्थितियों में अमोनिया गैस के निर्माण की ओर ले जाती हैं। रासायनिक समीकरण है
(v) Avogadro’s Law: एवोगैड्रो ने प्रस्ताव दिया कि, समान तापमान पर गैसों की समान मात्रा और दबाव में अणुओं की समान संख्या होनी चाहिए।
उदाहरण के लिए,
यदि हम पानी का उत्पादन करने के लिए हाइड्रोजन और ऑक्सीजन की प्रतिक्रिया पर विचार करते हैं, तो हम देखते हैं कि हाइड्रोजन के दो खंड ऑक्सीजन के एक मात्रा के साथ मिलकर बिना किसी ऑक्सीजन को छोड़े दो मात्रा में पानी देते हैं।
• Dalton’s Atomic Theory:
1808 में, डाल्टन ने 'रासायनिक दर्शन की एक नई प्रणाली' प्रकाशित की, जिसमें उन्होंने निम्नलिखित प्रस्ताव किया:
1. पदार्थ में अविभाज्य परमाणु होते हैं।
2. किसी दिए गए तत्व के सभी परमाणुओं में समान द्रव्यमान सहित समान गुण होते हैं। विभिन्न तत्वों के परमाणु द्रव्यमान में भिन्न होते हैं।
3. यौगिक तब बनते हैं जब विभिन्न तत्वों के परमाणु एक निश्चित अनुपात में संयोजित होते हैं।
4. रासायनिक प्रतिक्रियाओं में परमाणुओं का पुनर्गठन शामिल है। रासायनिक क्रिया में ये न तो बनते हैं और न ही नष्ट होते हैं।
• परमाणु भार
किसी तत्व का परमाणु द्रव्यमान उस संख्या का परमाणु है जो उस तत्व का परमाणु है जो 12. के रूप में लिए गए कार्बन के परमाणु से भारी है। यह ध्यान दिया जा सकता है कि ऊपर प्राप्त परमाणु द्रव्यमान सापेक्ष परमाणु द्रव्यमान हैं न कि वास्तविक द्रव्यमान। परमाणु।
एक परमाणु द्रव्यमान इकाई (एमू) कार्बन -12 आइसोटोप के एक परमाणु के द्रव्यमान के l / 12 वें के बराबर है। इसे एकीकृत द्रव्यमान के रूप में भी जाना जाता है।
औसत परमाणु द्रव्यमान
अधिकांश तत्व आइसोटोप के रूप में मौजूद हैं जो विभिन्न द्रव्यमान संख्याओं और एक ही परमाणु संख्या के साथ एक ही तत्व के विभिन्न परमाणु हैं। इसलिए, एक तत्व के परमाणु द्रव्यमान का औसत परमाणु द्रव्यमान होना चाहिए और इसे 12w के रूप में लिए गए कार्बन परमाणुओं (C-12) के द्रव्यमान की तुलना में तत्व के परमाणु के औसत सापेक्ष द्रव्यमान के रूप में परिभाषित किया जा सकता है।
मॉलिक्यूलर मास्स
आणविक द्रव्यमान एक अणु में मौजूद तत्वों के परमाणु द्रव्यमान का योग है। यह प्रत्येक तत्व के परमाणु द्रव्यमान को उसके परमाणुओं की संख्या से गुणा करके और उन्हें एक साथ जोड़कर प्राप्त किया जाता है।
उदाहरण के लिए,
मीथेन का आणविक द्रव्यमान (CH4)
= 12.011 यू + 4 (1.008 यू)
= 16.043 यू
फॉर्मूला मास
आयनिक यौगिक जैसे NaCl, KNO3, Na2C03 आदि।
• तिल संकल्पना
यह पाया जाता है कि किसी भी तत्व के एक ग्राम परमाणु में समान संख्या में परमाणु होते हैं और किसी भी पदार्थ के एक ग्राम अणु में समान संख्या में अणु होते हैं। इस संख्या को प्रयोगात्मक रूप से निर्धारित किया गया है और यह 6.022137 x 1023 के बराबर पाया जाता है। मूल्य को आम तौर पर एवोगैड्रो की संख्या या एवोगैड्रो की स्थिरांक कहा जाता है।
यह आमतौर पर NA द्वारा दर्शाया जाता है:
अवोगाद्रो की संख्या, NA = 6.022 × 1023
• प्रतिशत रचना
इस डेटा का विश्लेषण करके किसी दिए गए नमूने की शुद्धता की जांच कर सकते हैं। आइए हम पानी (H20) का उदाहरण लेते हैं। चूंकि पानी में हाइड्रोजन और ऑक्सीजन होता है, इसलिए इन दोनों तत्वों की प्रतिशत संरचना की गणना निम्न प्रकार से की जा सकती है
• अनुभवजन्य सूत्र
यौगिक का सूत्र जो यौगिक के एक अणु में मौजूद यार्सियस तत्वों के परमाणुओं का सरलतम संख्या अनुपात देता है।
उदाहरण के लिए, हाइड्रोजन पेरोक्साइड का सूत्र H202 है। इसके अनुभवजन्य सूत्र को व्यक्त करने के लिए, हमें एक सामान्य कारक को निकालना होगा। परमाणुओं का सबसे सरल पूर्ण संख्या अनुपात 1: 1 है और अनुभवजन्य सूत्र HO है। इसी तरह, ग्लूकोज का सूत्र C6H1206 है। परमाणुओं की सरलतम संख्या प्राप्त करने के लिए,
सामान्य कारक = 6
अनुपात = 1: 2: 1 ग्लूकोज का गुणात्मक सूत्र = CH20 है
• आण्विक सूत्र
एक यौगिक का सूत्र जो यौगिक के एक अणु में मौजूद विभिन्न तत्वों के परमाणुओं का वास्तविक अनुपात देता है।
उदाहरण के लिए, हाइड्रोजन पेरोक्साइड का आणविक सूत्र = H202and ग्लूकोज = C6H1206
आणविक सूत्र = n x अनुभवजन्य सूत्र
जहाँ n सामान्य कारक है और जिसे गुणा कारक भी कहा जाता है। N का मान 1, 2, 3, 4, 5, 6 आदि हो सकता है।
मामले में n 1 है, यौगिक का आणविक सूत्र = यौगिक का अनुभवजन्य सूत्र।
• स्टोइकोमेट्री और स्टोइकोमेट्रिक गणना
Word स्टोइकोमेट्री ’शब्द दो ग्रीक शब्दों से लिया गया है- स्टोयिऑन (अर्थ तत्व) और मेट्रोन (जिसका अर्थ है माप)। Stoichiometry, इस प्रकार अभिकर्मकों और एक रासायनिक प्रतिक्रिया में शामिल उत्पादों की जनता (कभी-कभी मात्रा भी) की गणना से संबंधित है।
 |
| Stoichiometry and Stoichiometric Calculations |
Limiting reactant / reagent For class 11 chemistry notes
कभी-कभी, रासायनिक समीकरण में, उपस्थित अभिकर्ता संतुलित समीकरण के अनुसार आवश्यक राशि नहीं होती है। तब बनने वाले उत्पादों की मात्रा अभिकारक पर निर्भर करती है जिसने पूरी तरह से प्रतिक्रिया की है।
यह अभिकारक जो अभिक्रिया में पूरी तरह से प्रतिक्रिया करता है उसे सीमित अभिकारक या अभिकर्मक को सीमित करना कहा जाता है। प्रतिक्रिया में जो अभिकारक पूरी तरह से नहीं खाया जाता है उसे अतिरिक्त अभिकारक कहते हैं।
समाधान में प्रतिक्रियाएं
जब समाधानों में प्रतिक्रियाएं की जाती हैं, तो इसके दिए गए आयतन में मौजूद पदार्थ की मात्रा निम्न में से किसी भी तरीके से व्यक्त की जा सकती है:
1. द्रव्यमान प्रतिशत या भार प्रतिशत (w / w%)
2. मोल अंश
3. मृदुलता
4. मोलभाव
1. द्रव्यमान प्रतिशत: यह निम्नलिखित संबंध का उपयोग करके प्राप्त किया जाता है:
• सभी पदार्थों में पदार्थ होते हैं जो तीन अवस्थाओं में मौजूद हो सकते हैं - ठोस, तरल या गैस।
• पदार्थ को तत्वों, यौगिकों और मिश्रण में भी वर्गीकृत किया जा सकता है।
• तत्व: एक तत्व में केवल एक प्रकार के कण होते हैं जो परमाणु या अणु हो सकते हैं।
• यौगिक तब बनते हैं जब दो या दो से अधिक तत्वों के परमाणु एक दूसरे से एक निश्चित अनुपात में जुड़ते हैं।
• मिश्रण: हमारे आसपास मौजूद कई पदार्थ मिश्रण हैं।
• वैज्ञानिक संकेतन: रसायन विज्ञान में मात्राओं की माप 10-31to 1023 के व्यापक विस्तार पर फैली हुई है। इसलिए, वैज्ञानिक संकेतन में संख्या को व्यक्त करने की एक सुविधाजनक प्रणाली का उपयोग किया जाता है।
• वैज्ञानिक आंकड़े: उन महत्वपूर्ण आंकड़ों की संख्या को निर्दिष्ट करके अनिश्चितता का ध्यान रखा जाता है जिनमें टिप्पणियों की सूचना दी जाती है।
• आयामी विश्लेषण: यह इकाइयों के विभिन्न प्रणालियों में मापा मात्रा को व्यक्त करने में मदद करता है।
• रासायनिक संयोजनों के नियम हैं:
(i) जन संरक्षण का कानून
(ii) निश्चित अनुपात का कानून
(iii) एकाधिक अनुपात का कानून
(iv) गे लूसैक का गैसीय वॉल्यूम का नियम
(v) अवोगाद्रो का नियम
• परमाणु द्रव्यमान: किसी तत्व का परमाणु द्रव्यमान कार्बन के 12C समस्थानिक के सापेक्ष व्यक्त किया जाता है जिसका सटीक मान 12u होता है।
• औसत परमाणु द्रव्यमान: उस तत्व के विभिन्न समस्थानिकों के प्राकृतिक प्रचुरता को ध्यान में रखकर प्राप्त किया जाता है।
• आणविक द्रव्यमान: एक अणु का आणविक द्रव्यमान एक अणु में मौजूद विभिन्न परमाणुओं के परमाणु द्रव्यमान का योग करके प्राप्त किया जाता है।
• एवोगैड्रो संख्या: किसी दिए गए सिस्टम में मौजूद परमाणुओं, अणुओं या किसी अन्य कण की संख्या एवोगैड्रो स्थिरांक के रूप में व्यक्त की जाती है।
= 6.022 x 1023
• संतुलित रासायनिक समीकरण: एक संतुलित समीकरण में समीकरण के दोनों तरफ प्रत्येक तत्व के परमाणुओं की समान संख्या होती है।
• class 11 chemistry chapter 1 notes For Stoichiometry :- आवश्यक अभिकारकों के मात्रात्मक अध्ययन या गठित उत्पादों को स्टोइकोमेट्री कहा जाता है। स्टोइकोमेट्रिक गणनाओं का उपयोग करके, किसी विशेष उत्पाद का उत्पादन करने के लिए आवश्यक एक या एक से अधिक अभिकारकों की मात्रा निर्धारित की जा सकती है और इसके विपरीत।










No comments:
Post a Comment