class 8 science chapter 4 Notes in Hindi - Notes For Hindi Medium
class 8 science notes in Hindi medium
Introduction
हमारे आस-पास की हर चीज को धातु या अधातु में वर्गीकृत किया जाता है। इसलिए, यह जानना महत्वपूर्ण है कि अधातु और धातु क्या हैं और उन्हें कैसे अलग किया जाए। कक्षा 8 विज्ञान अध्याय 4 धातुओं और अधातुओं के विभिन्न भौतिक और रासायनिक गुणों पर चर्चा करता है। इसमें आपकी सहायता के लिए, हम यहां धातुओं और अधातुओं के कुछ भौतिक और रासायनिक गुणों की सूची बना रहे हैं।
class 8 science chapter 4 Notes :- Metals
- धातुओं को रासायनिक तत्वों के रूप में वर्णित किया जाता है जो सकारात्मक आयन (धनायन) बनाने के लिए आसानी से वैलेंस इलेक्ट्रॉनों को खो देते हैं।
उदाहरण: एल्युमिनियम, तांबा, लोहा, टिन, सोना।
- कुल 118 तत्वों में से लगभग 90 तत्व धातु हैं।
class 8 science chapter 4 notes in Hindi for Physical Properties
- Physical Properties of Nonmetals
Occur as solids, liquids, and gases at room temperature
Brittle
Non-malleable
Non-ductile
Non-sonorous
Bad conductors of heat and electricity
- Exceptions in Physical Properties
क्षार धातुओं (Na, K, Li) को चाकू से काटा जा सकता है।
पारा एक तरल धातु है।
सीसा और पारा ऊष्मा के कुचालक हैं।
तापमान में मामूली बदलाव के लिए पारा महत्वपूर्ण रूप से फैलता है।
गैलियम और सीज़ियम का गलनांक बहुत कम होता है
आयोडीन अधातु है लेकिन इसमें चमक होती है।
ग्रेफाइट बिजली का संचालन करता है।
हीरा गर्मी का संचालन करता है और इसका गलनांक बहुत अधिक होता है।
class 8 science chapter 4 question answer in Hindi :- Physical Properties of Metals
- कठोर और उच्च तन्यता ताकत है
- पारा को छोड़कर कमरे के तापमान पर ठोस, जो कमरे के तापमान पर तरल होता है।
- सोनोरस
- ऊष्मा और बिजली के सुचालक
- निंदनीय, यानी पीटा जा सकता है पतली चादरों में
- तन्य, अर्थात पतले तारों में खींचा जा सकता है
- उच्च गलनांक और क्वथनांक (सीज़ियम (Cs) और गैलियम (Ga) को छोड़कर)
- सघन, (क्षार धातुओं को छोड़कर)। ऑस्मियम - उच्चतम घनत्व और लिथियम - न्यूनतम घनत्व
- चमकदार
- सिल्वर-ग्रे रंग, (सोने और तांबे को छोड़कर)
metals and non metals class 8 notes : Non-Metals
अधातु वे तत्व हैं जो धातुओं के गुणों को प्रदर्शित नहीं करते हैं।
उदाहरण: कार्बन, बोरॉन आदि।
metals and non metals class 8 notes : Chemical Properties of Metals
- क्षार धातुएं (Li, Na, K, आदि) पानी और ऑक्सीजन या वायु के साथ तीव्रता से प्रतिक्रिया करती हैं।
- Mg गर्म जल के साथ अभिक्रिया करता है।
- Al, Fe, और Zn भाप से अभिक्रिया करते हैं।
- Cu, Ag, Pt, Au जल या तनु अम्ल के साथ अभिक्रिया नहीं करते हैं।
class 8 science chapter 4 notes : Chemical Properties
विस्थापन प्रतिक्रियाएं [Displacement Reactions]
अधिक क्रियाशील तत्व कम क्रियाशील तत्व को उसके यौगिक या विलयन से विस्थापित कर देता है।
i) Zn(s)+CuSO4(aq)→ZnSO4(aq)+Cu(s)
ii) 2Al(s)+Fe2O3(पिघला हुआ)→Al2O3(s)+2Fe(पिघला हुआ)
ऑक्सीजन के साथ धातु की प्रतिक्रिया (हवा में जली हुई) [Metals Reaction with Oxygen (Burnt in Air)]
धातु + ऑक्सीजन → धातु ऑक्साइड (मूल)
Na और K को मिट्टी के तेल में डुबो कर रखा जाता है क्योंकि वे हवा के साथ जोरदार प्रतिक्रिया करते हैं और आग पकड़ लेते हैं।
4K(s)+O2(g)→2K2O(s) (जोरदार प्रतिक्रिया)
Mg, Al, Zn, Pb हवा के साथ धीरे-धीरे प्रतिक्रिया करते हैं और एक सुरक्षात्मक परत बनाते हैं जो जंग को रोकता है।
2Mg(s)+O2(g)→2MgO(s) (Mg एक सफेद चमकदार रोशनी के साथ जलता है)
4Al(s)+3O2(g)→2Al2O3(s)
चांदी, प्लेटिनम और सोना न जलते हैं और न ही हवा से प्रतिक्रिया करते हैं।
धातुओं के मूल ऑक्साइड [metals and non metals class 8 notes : Basic Oxides of Metals]
कुछ धात्विक ऑक्साइड जल में घुलकर क्षार बनाते हैं। इनका जलीय विलयन लाल लिटमस को नीला कर देता है।
Na2O(s)+H2O(l)→2NaOH(aq)
K2O(s)+H2O(l)→2KOH(aq)
धातुओं के उभयधर्मी ऑक्साइड [Amphoteric Oxides of Metals]
उभयधर्मी ऑक्साइड धातु के ऑक्साइड होते हैं जो अम्ल और क्षार दोनों के साथ प्रतिक्रिया करके नमक और पानी बनाते हैं।
उदाहरण के लिए – Al2O3,ZnO,PbO,SnO
Al2O3(s)+6HCl(aq)→2AlCl3(aq)+3H2O(l)
Al2O3(s)+2NaOH(aq)→2NaAlO2(aq)+H2O(l)
ZnO(s)+2HCl(aq)→ZnCl2(aq)+H2O(l)
ZnO(s)+2NaOH(aq)→Na2ZnO2(aq)+H2O(l)
प्रतिक्रियाशीलता श्रृंखला
नीचे दी गई तालिका धातुओं की उच्च कोटि से निम्न कोटि की अभिक्रियाशीलता को दर्शाती है।
जल/भाप के साथ धातुओं की अभिक्रिया [Reaction of Metals with Water/Steam]
Metal+Water→Metal hydroxide or Metal oxide+Hydrogen
2Na+2H2O(ठंडा)→2NaOH+H2+heat
Ca+2H2O(ठंडा)→Ca(OH)2+H2
Mg+2H2O(गर्म)→Mg(OH)2+H2
2Al+3H2O(भाप)→Al2O3+3H2
Zn+H2O(भाप)→ZnO+H2
धातुओं की अम्ल के साथ अभिक्रिया [Reaction of Metals with Acid]
- धातुएँ, जो हाइड्रोजन से अधिक क्रियाशील होती हैं, अपने तनु अम्लों से हाइड्रोजन को विस्थापित करती हैं और संबंधित धातु लवण और हाइड्रोजन गैस उत्पन्न करती हैं।
- उदाहरण: धातु + Metal+dilute acid→Salt+Hydrogen gas
2K(s)+H2SO4(dilute)→K2SO4(aq)+H2(g)
- धातुएँ, जो हाइड्रोजन से कम क्रियाशील होती हैं, अपने अम्लों से हाइड्रोजन को विस्थापित नहीं कर सकती हैं और इसलिए कोई प्रतिक्रिया नहीं होती है।
धातुएँ अन्य धातु लवणों के विलयन से किस प्रकार अभिक्रिया करती हैं [metals and non metals class 8 notes : How Do Metals React with Solution of Other Metal Salts]
उच्च क्रियाशील धातु निम्न क्रियाशील धातु को उसके लवण विलयन से विस्थापित कर देती है।
Metal A+Salt of metal B→Salt of metal A+Metal B
Fe(s)+CuSO4(aq)→FeSO4(aq)+Cu(s)
क्षारों के साथ धातुओं की अभिक्रिया [Reaction of Metals with Bases]
Base+metal→salt+hydrogen
2NaOH(aq)+Zn(s)→Na2ZnO2(aq)+H2(g), जब जिंक जलीय सोडियम हाइड्रॉक्साइड के साथ प्रतिक्रिया करता है तो यह सोडियम जिंकेट और हाइड्रोजन गैस देता है।
class 8 science chapter 4 question answer in Hindi
How Do Metals and Non-metals React
- धातुएँ संयोजकता इलेक्ट्रॉन खो देती हैं और धनायन बनाती हैं।
- अधातु उन इलेक्ट्रॉनों को अपने संयोजकता कोश में ग्रहण कर ऋणायन बनाते हैं।
- धनायन और आयन मजबूत इलेक्ट्रोस्टैटिक बल द्वारा एक दूसरे की ओर आकर्षित होते हैं, इस प्रकार एक आयनिक बंधन बनाते हैं।
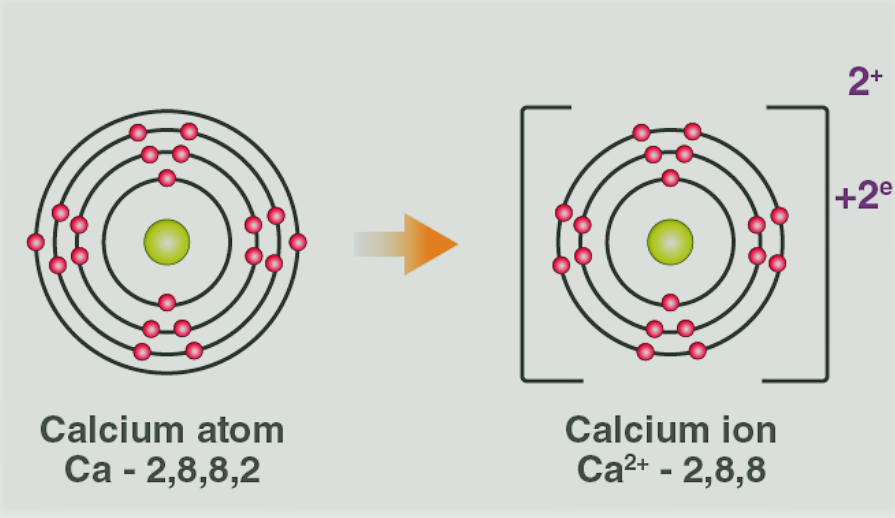
- उदाहरण के लिए: कैल्शियम क्लोराइड में, आयनिक बंधन विपरीत रूप से आवेशित कैल्शियम और क्लोराइड आयनों द्वारा बनता है।
- कैल्शियम परमाणु 2 इलेक्ट्रॉनों को खो देता है और निकटतम महान गैस (Ar) का इलेक्ट्रॉनिक विन्यास प्राप्त करता है। ऐसा करने पर उसे +2 का शुद्ध शुल्क प्राप्त होता है।
- दो क्लोरीन परमाणु एक-एक इलेक्ट्रॉन लेते हैं, इस प्रकार -1 (प्रत्येक) का चार्ज प्राप्त करते हैं और निकटतम महान गैस (Ar) का इलेक्ट्रॉनिक विन्यास प्राप्त करते हैं।
metals and non metals class 8 notes
metals and non metals class 8 notes :- Ionic Compounds
- आयनिक यौगिक रासायनिक यौगिक होते हैं जिनमें विपरीत आवेशित आयन इलेक्ट्रोस्टैटिक बलों द्वारा एक साथ बंधे रहते हैं जिन्हें आयनिक बंध कहा जाता है।
- एक आयनिक यौगिक में हमेशा धनात्मक और ऋणात्मक आवेशों का परिमाण समान होता है। उदाहरण के लिए: CaCl2, NaCl, K2SO4, आदि
Properties of Ionic Compounds
- आमतौर पर क्रिस्टलीय ठोस (आयनों से बने) होते हैं।
- उच्च गलनांक और क्वथनांक हैं।
- जलीय घोल में या पानी में पिघलाने पर और पिघलने पर बिजली का संचालन करें।
- ज्यादातर पानी और ध्रुवीय सॉल्वैंट्स में घुलनशील होते हैं।
class 8 science notes in hindi medium : Physical Properties of Ionic Compounds
- धनात्मक और ऋणात्मक आयनों के बीच प्रबल आकर्षण बल की उपस्थिति के कारण आयनिक यौगिक ठोस होते हैं और इन्हें तोड़ना कठिन होता है।
- दबाव डालने पर वे आम तौर पर टुकड़ों में टूट जाते हैं, इसलिए उन्हें भंगुर माना जाता है।
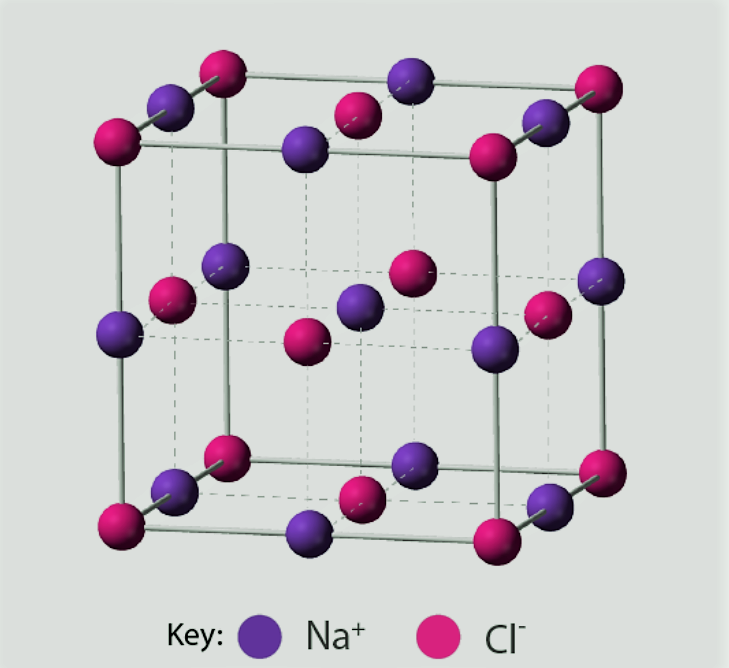
आयनिक यौगिकों की जाली संरचना [Lattice Structure of Ionic Compounds]
जाली कणों की एक नियमित व्यवस्था है, चाहे वे परमाणु हों, आयन हों या अणु हों।
आयनिक ठोस आमतौर पर नियमित, अच्छी तरह से परिभाषित क्रिस्टल संरचनाओं में मौजूद होते हैं।
class 8 science chapter 4 in hindi medium
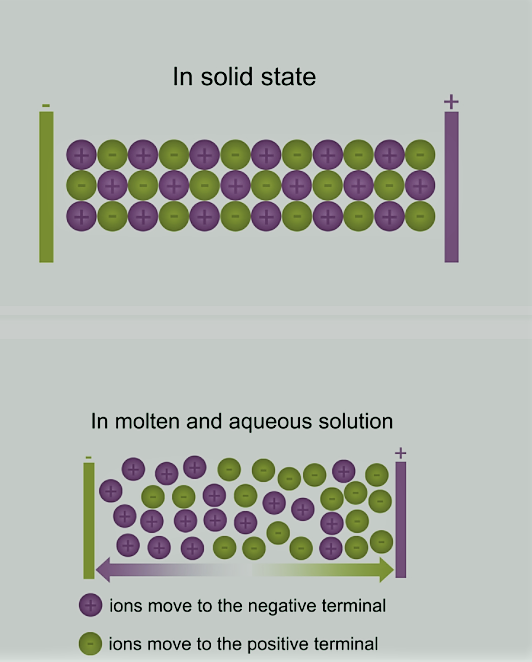
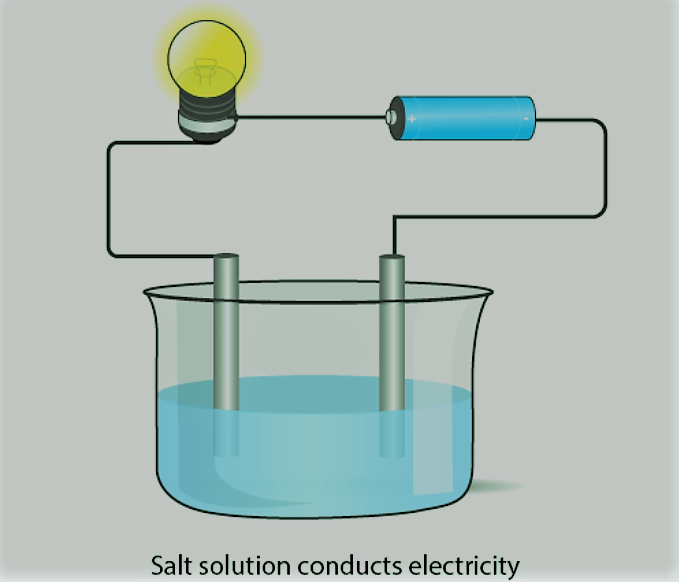
आयनिक यौगिकों का विद्युत चालन [Electric Conduction of Ionic Compounds]
जब आयन मुक्त हो जाते हैं और आवेश वाहक के रूप में कार्य करते हैं, तो आयनिक यौगिक गलित या जलीय अवस्था में विद्युत का संचालन करते हैं।
ठोस रूप में, आयनों को आकर्षण के इलेक्ट्रोस्टैटिक बलों द्वारा दृढ़ता से धारण किया जाता है और स्थानांतरित करने के लिए स्वतंत्र नहीं होता है; इसलिए बिजली का संचालन न करें।
Electric Conduction of Ionic Compounds
उदाहरण के लिए, NaCl जैसे आयनिक यौगिक विद्युत का संचालन नहीं करते हैं जब ठोस विद्युत का संचालन करते हैं लेकिन जब पानी में या पिघली हुई अवस्था में घुलते हैं, तो यह बिजली का संचालन करेगा।
metals and non metals class 8 notes
आयनिक यौगिकों के गलनांक और क्वथनांक [Melting and Boiling Points of Ionic Compounds]
आयनिक यौगिकों में, आयनों के बीच मजबूत इलेक्ट्रोस्टैटिक बलों को तोड़ने के लिए उच्च मात्रा में ऊर्जा की आवश्यकता होती है। इस प्रकार, एक आयनिक यौगिक का गलनांक और क्वथनांक आमतौर पर बहुत अधिक होता है।
आयनिक यौगिक की घुलनशीलता [class 8 science notes in Hindi medium :- Solubility of Ionic Compound]
आयनिक यौगिक आमतौर पर पानी जैसे ध्रुवीय सॉल्वैंट्स में घुलनशील होते हैं, जबकि क्लोरोफॉर्म, तेल आदि जैसे गैर-ध्रुवीय सॉल्वैंट्स में घुलनशीलता कम हो जाती है।
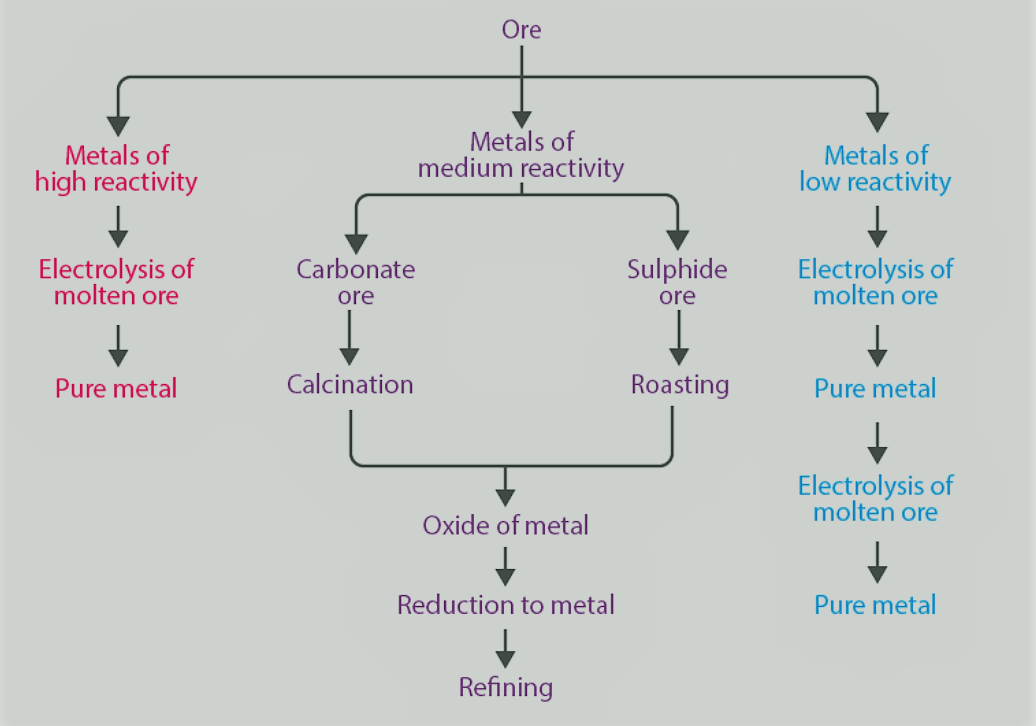
धातुओं और अधातुओं का निष्कर्षण [Extraction of Metals and Non-Metals]
धातुओं और अधातुओं के अनुप्रयोग [Applications of Metals and Non-metals]
लोहे को जंग लगने से बचाने के लिए जिंक का उपयोग किया जाता है।
आभूषण बनाने के लिए सोने और चांदी का उपयोग किया जाता है।
ऑक्सीजन का उपयोग पौधों और जानवरों द्वारा किया जाता है।
अमोनिया, नाइट्रिक एसिड और उर्वरकों की तैयारी के लिए नाइट्रोजन का उपयोग किया जाता है।
पानी को शुद्ध करने के लिए क्लोरीन का उपयोग किया जाता है।
विभिन्न उद्योगों में कांच काटने के लिए हीरे का उपयोग किया जाता है।
- धातुओं की घटना [Occurrence of Metals]
अधिकांश तत्व विशेष रूप से धातु प्रकृति में अन्य तत्वों के साथ संयुक्त अवस्था में पाए जाते हैं। धातुओं के इन सभी यौगिकों को खनिज कहते हैं। लेकिन उनमें से कुछ ही उस धातु के व्यवहार्य स्रोत हैं। ऐसे स्रोतों को अयस्क कहा जाता है।
Au, Pt – मूल या मुक्त अवस्था में मौजूद हैं।
Roasting
भूनना:- सल्फाइड अयस्कों को अधिक वायु की उपस्थिति में अत्यधिक गर्म करने पर धातु के ऑक्साइडों में परिवर्तित करता है।
यह वाष्पशील अशुद्धियों को भी दूर करता है।
2ZnS(s)+3O2(g)+हीट→2ZnO(s)+2SO2(g)
Calcination
कैल्सीनेशन: सीमित हवा की उपस्थिति में दृढ़ता से गर्म करने पर कार्बोनेट और हाइड्रेटेड अयस्कों को ऑक्साइड में परिवर्तित करता है। यह वाष्पशील अशुद्धियों को भी दूर करता है।
ZnCO3(s)+heat→ZnO(s)+CO2(g)
CaCO3(s)+heat→CaO(s)+CO2(g)
रोस्टिंग और कैल्सीनेशन के बारे में अधिक जानने के लिए, यहाँ जाएँ।
धातुओं का निष्कर्षण, जो प्रतिक्रियाशीलता श्रृंखला में कम हैं [Extraction of Metals, Which Are Lower in the Reactivity Series]
सोना, चांदी, प्लेटिनम और तांबा जैसी धातुएं सबसे कम प्रतिक्रियाशील होती हैं और मुक्त अवस्था में पाई जाती हैं।
कॉपर और सिल्वर भी संयुक्त अवस्था में उनके सल्फाइड या ऑक्साइड अयस्क के रूप में पाए जाते हैं। ये धातुएं आमतौर पर सल्फाइड अयस्कों के रूप में होती हैं, जो आगे भून जाती हैं।
- धातुओं का निष्कर्षण, जो प्रतिक्रियाशीलता श्रृंखला में मध्य-मार्ग हैं
Zn, Fe, Pb, आदि जैसी धातुएँ मध्यम रूप से प्रतिक्रियाशील होती हैं और आमतौर पर प्रकृति में ऑक्साइड, सल्फाइड या कार्बोनेट के रूप में मौजूद होती हैं।
कार्बोनेट और सल्फाइड अयस्कों को क्रमशः कैल्सीनेशन और रोस्टिंग के अधीन किया जाता है, इसके बाद धातुओं को प्राप्त करने के लिए धातु ऑक्साइड की कमी होती है।
- धातुओं का निष्कर्षण, जो प्रतिक्रियाशीलता श्रृंखला के शीर्ष पर हैं
ऑक्सीजन के लिए उच्च आत्मीयता के कारण सी के साथ कम करके Na, Ca, Mg, Al, आदि प्राप्त नहीं किया जा सकता है।
ये धातुएँ गलित अवस्था में उनके ऑक्साइड, हाइड्रॉक्साइड या क्लोराइड के इलेक्ट्रोलाइटिक अपचयन या इलेक्ट्रोलिसिस द्वारा प्राप्त की जाती हैं।
अयस्क का संवर्धन [Enrichment of Ores]
इसका अर्थ है विभिन्न भौतिक और रासायनिक प्रक्रियाओं के माध्यम से अयस्क से अशुद्धियों या गैंग को हटाना। किसी विशेष अयस्क के लिए उपयोग की जाने वाली तकनीक अयस्क और गैंग के गुणों में अंतर पर निर्भर करती है।
धातुओं का शोधन [Refining of Metals]
धातुओं का शोधन - कच्चे धातु से अशुद्धियों या गैंग को हटाना। यह धातु विज्ञान में अंतिम चरण है और धातु और गैंग्यू के गुणों के बीच के अंतर पर आधारित है।
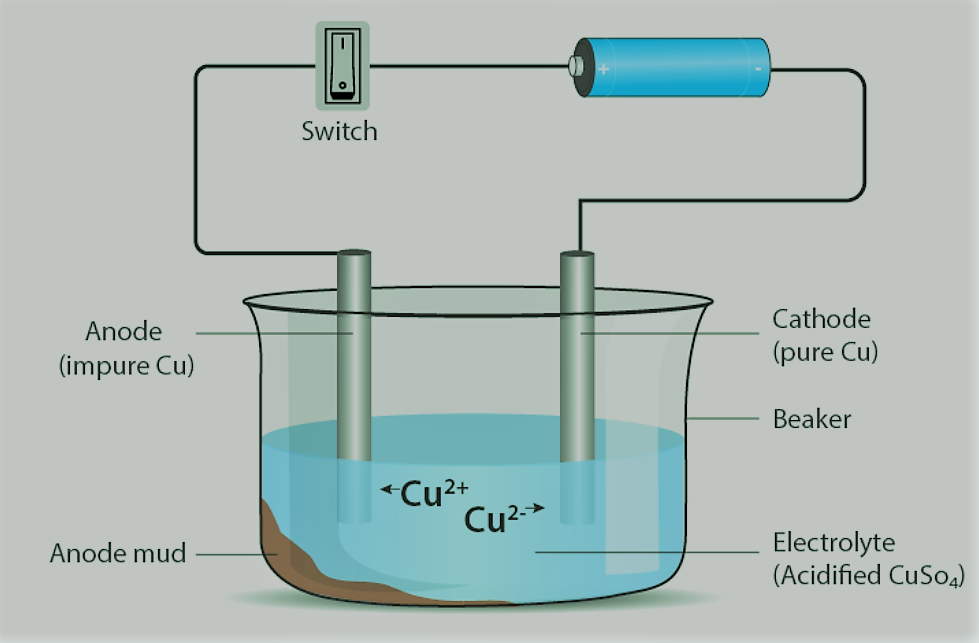
metals and non metals class 8 notes :- Electrolytic Refining
विद्युत धारा के पारित होने पर शुद्ध धातु प्राप्त करने के लिए अशुद्ध धातु को शुद्ध करने की प्रक्रिया को इलेक्ट्रोलाइटिक शोधन कहा जाता है।
तांबा, जस्ता, निकल, चांदी, टिन, सोना आदि धातुओं को इलेक्ट्रोलाइटिक रूप से परिष्कृत किया जाता है।
एनोड - अशुद्ध या कच्ची धातु
कैथोड - शुद्ध धातु की एक पतली पट्टी
इलेक्ट्रोलाइट - धातु नमक का जलीय घोल एनोड (ऑक्सीकरण) से - धातु आयनों को घोल में छोड़ा जाता है
कैथोड पर (कमी) - विलयन से धातु के बराबर मात्रा में जमा होता है
एनोड के तल पर अशुद्धियाँ जमा होती हैं।
ncert solutions for class 8 science in hindi medium











No comments:
Post a Comment