chemistry chapter 8 notes for class 11
Redox Reactions class 11 chemistry chapter 8 notes in Hindi
• Oxidation
ऑक्सीकरण को एक पदार्थ से ऑक्सीजन / इलेक्ट्रोनगेटिव तत्व के अलावा या एक susbtance से हाइड्रोजन / इलेक्ट्रोपोसिटिव तत्व के रिमेमोवल के रूप में परिभाषित किया गया है।
उदाहरण के लिए,

Oxidation
• Reduction
न्यूनीकरण को किसी पदार्थ से ऑक्सीजन / इलेक्ट्रोनगेटिव तत्व के मेमोवल के रूप में या किसी पदार्थ को हाइड्रोजन या इलेक्ट्रोपोसिटिव तत्व के अतिरिक्त के रूप में परिभाषित किया गया है।
उदाहरण के लिए,

class 11 chemistry chapter 8 notes
• Redox Reaction in Terms of Electron Transfer Reaction
इलेक्ट्रॉनिक अवधारणा के आधार पर रेडॉक्स प्रतिक्रिया के कुछ उदाहरण नीचे दिए गए हैं:
इलेक्ट्रॉनिक अवधारणा के अनुसार हर रेडॉक्स प्रतिक्रिया में दो चरण होते हैं जिन्हें आधी प्रतिक्रिया के रूप में जाना जाता है।
(i) ऑक्सीकरण प्रतिक्रिया: इलेक्ट्रॉनों के नुकसान में शामिल होने वाली आधी प्रतिक्रियाओं को ऑक्सीकरण प्रतिक्रिया कहा जाता है।
(ii) न्यूनीकरण प्रतिक्रिया: इलेक्ट्रॉनों की प्राप्ति में शामिल होने वाली आधी प्रतिक्रियाओं को कमी प्रतिक्रिया कहा जाता है।
Oxidising agent: Acceptor of electrons.
Reducing agent: Donar of electrons.

class 11 chemistry redox reaction notes
• Competitive Electron Transfer Reactions redox reaction class 11 notes in Hindi
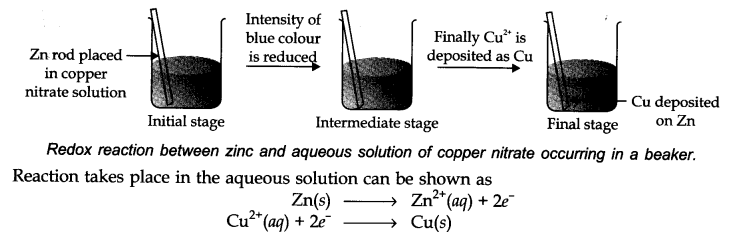
इस अवधारणा को समझने के लिए हमें एक प्रयोग करना चाहिए।
तांबे नाइट्रेट के एक जलीय घोल में धातु जस्ता की एक पट्टी रखें जैसा कि अंजीर में दिखाया गया है। एक घंटे के बाद परिवर्तनों पर ध्यान दिया जाएगा।
(i) स्ट्राइप्स रेडिश मेटालिक कॉपर से कोटेड हो जाता है।
(ii) विलयन का नीला रंग गायब हो जाता है।
(iii) यदि हाइड्रोजन सल्फाइड गैस को सफ़ेद ZnS के विलयन स्वरूप से गुजारा जाए तो - अमोनिया के साथ घोल को क्षारीय बनाने पर देखा जा सकता है।
notes of redox reaction class 11 chemistry
• oxidation number For redox reactions notes in Hindi /oxidation number definition
यह एक यौगिक में एक तत्व का ऑक्सीकरण राज्य है जो एक यौगिक के एक परमाणु को सौंपा गया चार्ज है एक परमाणु के वाल्व खोल में इलेक्ट्रॉनों की संख्या के बराबर है जो पूरी तरह से प्राप्त होते हैं या पूरी तरह से या उस परमाणु से काफी हद तक खो जाते हैं। एक यौगिक में एक बंधन बनाते समय।
• Rules for Assigning Oxidation Numbers
(i) इसके प्रारंभिक रूप में एक तत्व की ऑक्सीकरण संख्या शून्य है।
उदाहरण के लिए, H2, 02, N2 आदि में ऑक्सीकरण संख्या शून्य के बराबर है।
(ii) एकल मोनोआटोमिक आयन में, आयन पर आवेश के बराबर ऑक्सीकरण संख्या होती है। उदाहरण के लिए, Na+ ion में +1 और Mg2+ ion का ऑक्सीकरण संख्या +2 है।
(iii) ऑक्सीजन के यौगिकों में ऑक्सीकरण संख्या -2 है। हालांकि, कुछ अपवाद हैं।
पेरोक्साइड जैसे यौगिक। Na202, H202
ऑक्सीजन की ऑक्सीकरण संख्या = – 1 In OF2 में
पर। ऑक्सीजन = +2 02F2पर।
ऑक्सीजन का = +1
(iv) हाइड्रोजन के गैर-धातु यौगिकों जैसे HCl, H2S, H2O में हाइड्रोजन की ऑक्सीकरण संख्या = + 1 होती है, लेकिन धातु हाइड्राइड में हाइड्रोजन की ऑक्सीकरण संख्या = -1
[LiH, NaH, CaH2 etc.]
(v) धातुओं और गैर-धातुओं के यौगिकों में सकारात्मक ऑक्सीकरण संख्या होती है जबकि गैर-धातुओं में नकारात्मक ऑक्सीकरण संख्या होती है। उदाहरण के लिए, NaCl में। Na में +1 ऑक्सीकरण संख्या है जबकि क्लोरीन में -1 है।
(vi) यदि किसी यौगिक में दो अधातुएँ हैं, तो उच्च विद्युत के साथ परमाणुओं को ऋणात्मक ऑक्सीकरण संख्या दी जाती है, जबकि अन्य परमाणुओं में धनात्मक ऑक्सीकरण संख्या होती है।
(vii) किसी यौगिक में सभी परमाणुओं की ऑक्सीकरण संख्या का बीजगणितीय योग शून्य के बराबर होता है।
(viii) पाली परमाणु आयन में ऑक्सीकरण संख्या का योग। आयन में सभी परमाणु आयन पर शुद्ध आवेश के बराबर होते हैं।
उदाहरण के लिए, (C03)2— कार्बन परमाणुओं और तीन ऑक्सीजन परमाणुओं का योग -2 के बराबर है।
फ्लोरीन (F2) इतना उच्च प्रतिक्रियाशील गैर-धातु है कि यह पानी से ऑक्सीजन को विस्थापित करता है।
 |
| oxidation number rules |
अनुपातहीनता प्रतिक्रिया। एक असंतुलन प्रतिक्रिया में एक ऑक्सीकरण अवस्था में एक तत्व एक साथ ऑक्सीकरण और कम हो जाता है।
उदाहरण के लिए,
इसलिए, पेरोक्साइड की ऑक्सीजन, जो -1 ऑक्सीकरण अवस्था में मौजूद है, शून्य ऑक्सीकरण अवस्था से जुड़ी है और 02 में और एच 2 ओ में -2 ऑक्सीकरण अवस्था में घट जाती है।
• Fractional Oxidation Numbers for class 11 chemistry chapter 8 notes in Hindi
इस तरह के तत्वों में कोई भिन्नात्मक ऑक्सीकरण संख्या नहीं होती है। जब एक ही तत्व एक प्रजाति में अलग-अलग बंधन में शामिल होता है, तो उनकी वास्तविक ऑक्सीकरण अवस्था पूरी संख्या में होती है, लेकिन इनमें से एक औसत भिन्नात्मक होता है।
उदाहरण के लिए, C302 में

chapter 8 chemistry class 11 notes
आंशिक ओ.एन. किसी विशेष तत्व को केवल तब ही बंद किया जा सकता है जब हम यौगिक की संरचना के बारे में जानते हैं या जिसमें यह मौजूद है।
• Balancing of Redox Reactions
(i) ऑक्सीकरण संख्या विधि। निम्नलिखित कदम शामिल हैं:
(ii) प्रत्येक अभिकारक और उत्पाद के लिए सही सूत्र लिखिए।
(b) ऑक्सीकरण संख्या में ऑक्सीकरण परिवर्तन बताकर पहचाना जा सकता है।
(c) अभिकारकों के संबंध में प्रति परमाणु में ऑक्सीकरण संख्या में वृद्धि और कमी की गणना करें। यदि एक से अधिक परमाणु मौजूद हैं तो उपयुक्त गुणांक से गुणा करें।
(d) सभी परमाणुओं के संबंध में समीकरण को संतुलित करें। संतुलन हाइड्रोजन और ऑक्सीजन परमाणु भी।
(e) यदि अम्लीय माध्यम में प्रतिक्रिया होती है, तो समीकरण में H + आयनों का उपयोग करें। यदि यह मूल माध्यम में है तो OH- आयनों का उपयोग करें।
(च) अभिव्यक्ति में हाइड्रोजन परमाणुओं को अभिकारकों या उत्पादों में (H20) अणुओं को जोड़कर संतुलित किया जा सकता है।
यदि समीकरण के दोनों ओर समान संख्या में ऑक्सीजन परमाणु हैं तो यह संतुलित रेडॉक्स प्रतिक्रिया का प्रतिनिधित्व करता है।
(ii) आधी प्रतिक्रिया विधि। इस विधि में दो आधे समीकरण को अलग-अलग संतुलित किया जाता है और संतुलित समीकरण देने के लिए एक साथ जोड़ा जाता है।

chapter 8 chemistry class 11 notes
• Redox Reactions as the Basis for Titration
पोटेशियम परमैंगनेट अनुमापन: इन अनुमापनों में पोटेशियम परमैंगनेट (रंग में गुलाबी) अम्लीय माध्यम में ऑक्सीकरण एजेंट के रूप में कार्य करता है जबकि ऑक्सालिक एसिड या कुछ लौह लवण एक कम करने वाले एजेंट के रूप में कार्य करता है।
आयनिक समीकरण को इस प्रकार लिखा जा सकता है:
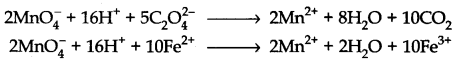
ये redox अनुमापन के उदाहरण हैं।
इन दोनों अनुमापनों पर, पोटेशियम परमैंगनेट स्वयं संकेतक के रूप में कार्य करता है। इसे आमतौर पर सेल्फ इंडिकेटर के रूप में जाना जाता है। समाधान में गुलाबी रंग की उपस्थिति अंत बिंदुओं का प्रतिनिधित्व करती है।
पोटेशियम डाइक्रोमेट अनुमापन: पोटेशियम परमैंगनेट के स्थान पर, पोटेशियम डाइक्रोमेट का उपयोग तनु की उपस्थिति में भी किया जा सकता है।
dil. H2S04 FeS04 (Fe2+ ions) के साथ रेडॉक्स प्रतिक्रिया के लिए आयनिक समीकरण दिया गया है।
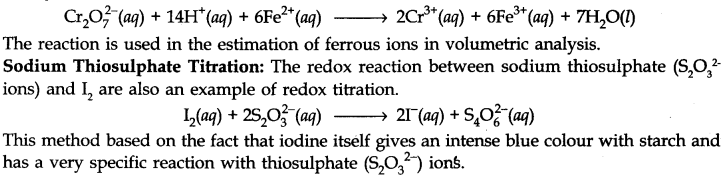
Redox Reactions as the Basis for Titration
• Limitation of Concept of Oxidation Number
ऑक्सीकरण संख्या की अवधारणा के अनुसार, ऑक्सीकरण का मतलब ऑक्सीकरण संख्या में वृद्धि होती है - इलेक्ट्रॉनों की हानि से और कमी का मतलब इलेक्ट्रॉनों की प्राप्ति से ऑक्सीकरण संख्या में कमी होती है।
हालांकि, ऑक्सीकरण के दौरान इलेक्ट्रॉन घनत्व में कमी होती है, जबकि परमाणु के आसपास इलेक्ट्रॉन घनत्व में वृद्धि घटती है।
• Redox Reactions and Electrode Processes—Electrochemical Cells
एक उपकरण जिसमें रेडॉक्स प्रतिक्रिया को परोक्ष रूप से किया जाता है और ऊर्जा में कमी विद्युत ऊर्जा के रूप में प्रकट होती है जिसे विद्युत रासायनिक सेल कहा जाता है।
इलेक्ट्रोलाइटिक सेल। वह कोशिका जिसमें विद्युत ऊर्जा को रासायनिक ऊर्जा में परिवर्तित किया जाता है। उदाहरण के लिए, जब सीसा भंडारण बैटरी को रिचार्ज किया जाता है, तो यह इलेक्ट्रोलाइटिक सेल के रूप में कार्य करता है।
Redox Reactions and Electrode Processe जब जस्ता की छड़ को कॉपर सल्फेट घोल में डुबोया जाता है तो रेडॉक्स अभिक्रिया शुरू होती है, इसलिए जस्ता को Zn2 + आयनों में ऑक्सीकरण किया जाता है और Cu2 + आयनों को धातु में घटाया जाता है।
• रेडॉक्स प्रतिक्रिया। जिन प्रतिक्रियाओं में ऑक्सीकरण और कमी एक साथ होती है, उन्हें रेडॉक्स प्रतिक्रिया कहा जाता है।
• Oxidation :- एक या एक से अधिक इलेक्ट्रॉनों की हानि को आमंत्रित करता है।
• Reduction :- एक या अधिक इलेक्ट्रॉनों का लाभ प्राप्त करता है।
• Oxidising agent इलेक्ट्रॉनों को स्वीकार करना।
• Reducing agent इलेक्ट्रॉनों का हारना।
• Electrochemical cell : - यह एक ऐसा उपकरण है जिसमें रेडॉक्स प्रतिक्रिया को परोक्ष रूप से किया जाता है और ऊर्जा में कमी विद्युत ऊर्जा देती है।
• Electrode potential :- यह समाधान में इलेक्ट्रोड और उसके आयनों के बीच संभावित अंतर है।
• Standard electrode potential यह मानक हाइड्रोजन इलेक्ट्रोड के संबंध में एक इलेक्ट्रोड की क्षमता है।
• Electrochemical series :- यह गतिविधि श्रृंखला है। इसका गठन धातुओं की व्यवस्था के लिए मानक कमी संभावित मूल्य को बढ़ाने के लिए किया गया है।











No comments:
Post a Comment